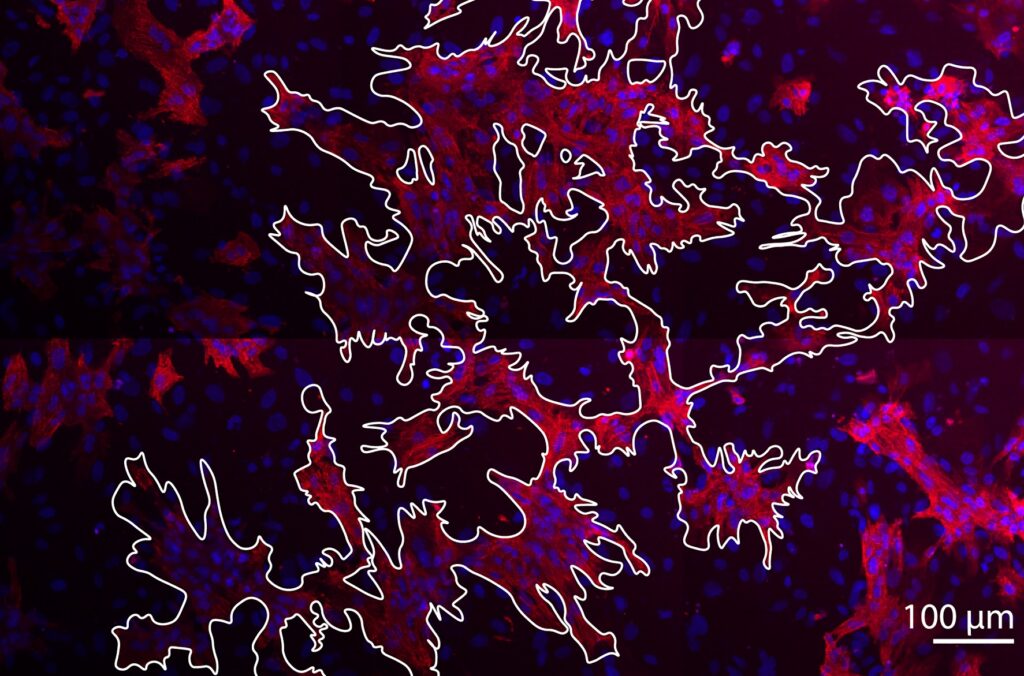
Рисунок 1. На фотографии, сделанной с помощью конфокального микроскопа, белым контуром выделен проводящий путь из кардиомиоцитов в монослое сердечной ткани (31% кардиомиоцитов и 69% непроводящих клеток). Кардиомиоциты помечены розовым цветом, ядра – синим. Фото стало обложкой журнала PLOS Computational Biology
Сердце сокращается благодаря распространению электрических волн в сердечной ткани. Нарушение нормального режима распространения таких волн может стать причиной сердечной аритмии, асинхронных сердечных сокращений и даже привести к остановке сердца или внезапной сердечной смерти. Биофизики из МФТИ и Гентского университета (Бельгия) выяснили, что сердечная ткань, несмотря на высокое содержание невозбудимых клеток (до 75%), все-таки может проводить возбуждение. Это происходит благодаря взаимодействию возбудимых сердечных клеток — кардиомиоцитов — и образованию ими разветвленной проводящей сети. Работа опубликована в журнале PLOS Computational Biology.
Как уже упоминалось выше, генераторами и проводниками электрических волн в сердце служат возбудимые клетки — кардиомиоциты. Кроме кардиомиоцитов, в сердечной ткани есть клетки соединительной ткани, которые не передают возбуждение. К ним относятся, например, фибробласты. В сердце здорового человека фибробласты поддерживают его структурную целостность и участвуют в устранении повреждений. При инфаркте и некоторых других сердечных заболеваниях и патологиях кардиомиоциты умирают — их место занимают фибробласты. Этот процесс можно сравнить с образованием шрамов при повреждении кожных покровов. Чрезмерное содержание фибробластов в сердечной ткани мешает распространению электрических сигналов. Такое нарушение называется сердечным фиброзом, и именно оно является частой причиной аритмии.
Парадокс фиброзной ткани
Непроводящие клетки, фибробласты, являются препятствием для движения электрической волны. Пытаясь обойти препятствие, волна начинает его огибать, что может приводить к циркуляции возбуждения — возникновению вращающейся спиральной волны. Такое явление называется ре-ентри и вызывает аритмию. Можно предположить, что высокая плотность фибробластов в сердечной ткани способствует формированию ре-ентри по двум причинам. Во-первых, фибробласты выступают в роли неоднородностей, которые препятствуют проведению электрического сигнала. Во-вторых, высокое содержание фибробластов строит своеобразный «лабиринт» для волн, и они следуют по более длинному зигзагообразному пути.
Критическая плотность непроводящих клеток, выше которой сердечная ткань не должна проводить возбуждение, называется порогом перколяции. Его вычисляют с помощью теории перколяции, математического метода описания возникновения связных структур, в качестве которых в данной задаче выступают случайно распределенные проводящие и непроводящие клетки сердечной ткани. Согласно расчетам, сердечная ткань должна терять проводимость для электрических волн, если фибробластов в ней станет больше 40%. Парадокс в том, что, по данным экспериментов, образцы ткани с содержанием фибробластов, много превышающим порог перколяции (65–75%), все еще проводят электрические сигналы. Это означает, что должен существовать механизм, ответственный за проводниковую самоорганизацию кардиомиоцитов.
Чтобы разрешить этот парадокс, ученые совместили эксперименты «in vitro» — в искусственно смоделированной среде — на монослое сердечных клеток новорожденных крыс с экспериментами «in silico» — в полностью смоделированной на компьютере биологической системе — на морфологической и электрофизиологической компьютерной модели сердечной ткани.
Гипотеза выравнивания цитоскелетов
Кардиомиоциты сердца представляют собой синцитий — функциональное объединение большого числа тесно взаимосвязанных клеток. За счет такого объединения возбуждение только одной клетки приводит к распространению по всем клеткам сердечного синцития. Группой исследователей была выдвинута никогда не рассматриваемая ранее гипотеза: в фиброзной ткани кардиомиоциты выравнивают свои цитоскелеты для образования единого синцития вместе с остальной сердечной тканью.
«Мы фиксировали распространение электрической волны в 25 монослойных образцах сердечной ткани с разным процентным содержанием кардиомиоцитов и фибробластов. Так из экспериментов „in vitro“ нам удалось рассчитать порог перколяции — оказалось, что он составляет 75% фибробластов. Это число сильно отличается от предсказанных с помощью теории перколяции или других классических математических моделей 40%. Далее мы заметили, что кардиомиоциты в образцах располагаются не случайным образом, а собираются в разветвленную проводящую сеть. Учет этого факта помог воспроизвести полученные „in vitro“ результаты с прогнозами „in silico“ в компьютерной модели», — поясняет профессор Константин Агладзе, руководитель лаборатории биофизики возбудимых систем МФТИ.
Благодаря такому предположению в рамках компьютерной модели удалось успешно воспроизвести не только морфологию проводящих путей, но и наблюдаемые в экспериментах «in vitro» спад скорости и высокий порог перколяции.

Рисунок 2. Синцитий сердца в трехдневной культуре кардиомиоцитов новорожденных крыс. Клетки образовали ветвящуюся сеть. Красные стрелки указывают на вставочные диски между клетками. Белые стрелки указывают на нити цитоскелета (зеленые), продолжающие друг друга с разных сторон от вставочного диска. Ядра показаны синим цветом. Источник: PLOS Computational Biology

