Несмотря на значительные успехи в диагностике и лечении, фибрилляция предсердий до сих поражает до 2% населения. Это делает ее наиболее распространенной аритмией во всем мире. Ученые МФТИ рассмотрели индивидуальный способ диагностики фиброза с помощью новой компьютерной модели, которая строит свой прогноз лечения на основе данных магнитно-резонансной томографии с гадолинием. Результат исследования опубликован в журнале Biochemistry.
Фибрилляция предсердий (мерцательная аритмия) — результат сложного взаимодействия факторов риска и сопутствующих заболеваний. Это распространенное нарушение сердечного ритма, при котором верхние камеры сердца сокращаются несинхронно с желудочками, что увеличивает риск образования тромбов, а также вероятность инсульта и сердечной недостаточности. Разнообразие проявлений и широкий спектр механизмов, участвующих в возникновении и прогрессировании фибрилляции, значительно повышают значимость выявления причинных факторов этого опасного заболевания.
Распространенный метод лечения мерцательной аритмии — изоляция легочных вен с помощью катетерной абляции, выжигания очага аритмии электрическим током высокой частоты. Но частота рецидивов после этой процедуры — 40–60%. Одна из гипотез, объясняющая причину столь невысокой эффективности такого лечения, связана с самим фиброзом, который создает субстрат, и с его помощью аритмогенная предрасположенность распространяется за пределы области, затронутой изоляцией легочных вен.
В связи с этим ученые ищут новые методы абляции и в последнее время активно применяют имитационное моделирование. Развитие компьютерного моделирования в целом открыло новые возможности для понимания механизмов, прогнозирования рисков и персонализированной терапии при лечении фиброза. Но на пути к созданию полноценной модели сотрудники лаборатории экспериментальной и клеточной медицины МФТИ столкнулись с вопросом различия общего моделировании предсердий со специфической электрофизиологией пациентов. В результате было проведено исследование на тему, могут ли изменения ионных токов в сердце объяснить различия в возникновении волн re-entry (механизм повторного входа), когда электрический импульс непрерывно циркулирует внутри сердечной ткани, приводя к повторной активации предсердий, у пациентов с нормальным потенциалом и с хронической фибрилляцией предсердий.
Таким образом, ученые исследовали фиброз как субстрат для возникновения re-entry с чисто электрофизиологической точки зрения. Было продемонстрировано влияние на структуру предсердий, специфичную для пациента, при нормальной электрофизиологии и при длительной фибрилляции.
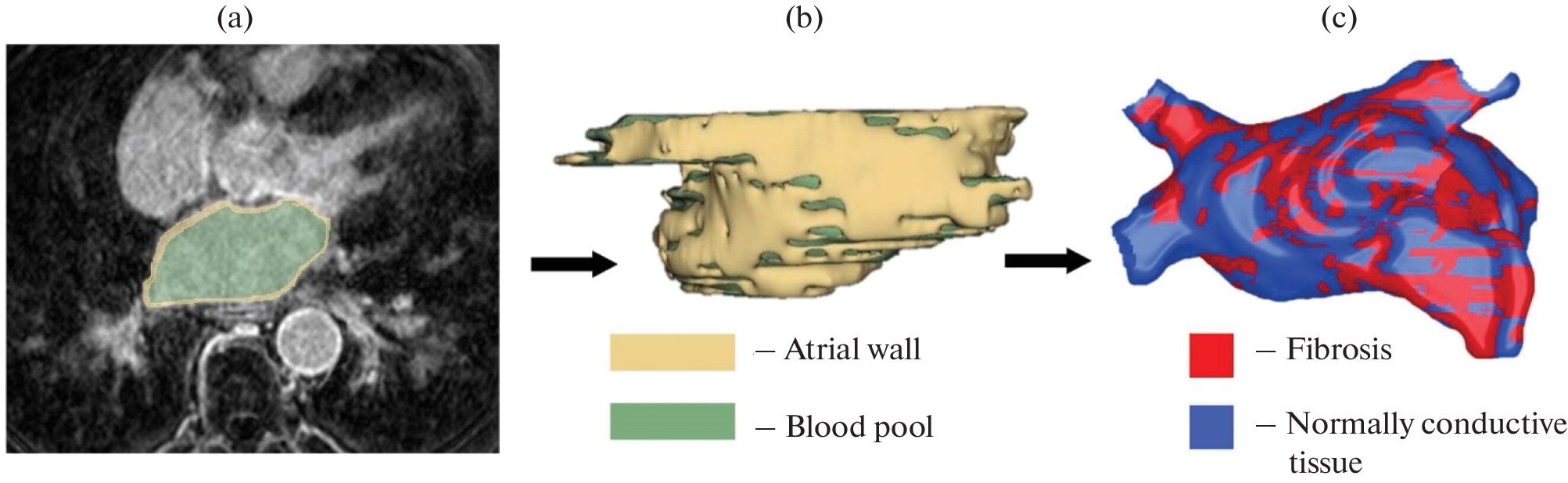
Создание модели предсердия на основе МРТ-изображения. (а) Пример данных МРТ. На панели показан пример сегментированного среза: желтым цветом обозначена стенка левого предсердия, зеленым — кровоток. (б) Трехмерная модель левого предсердия пациента (стенка предсердия на панели обозначена желтым цветом, кровоток — зеленым). (c) Модель предсердия воспроизводит картину фиброза, близкую к той, что наблюдается у пациентов с фибрилляцией предсердий (фиброз обозначен красным, здоровая ткань — синим). Источник: Biochemistry (Moscow), Supplement Series A: Membrane and Cell Biology
«Наше исследование посвящено индивидуальным моделям предсердия, созданным с помощью снимков МРТ пациентов. С помощью подобных моделей можно рассчитать эффективность антиаритмического препарата, который будет назначен врачом. Это существенно повышает возможности персональной профилактики.
Мы реконструируем предсердную проводимость. Снимки МРТ с контрастным усилением гадолиния показывают очаги фиброза, которые и отвечают за возникновение аритмий. Строим по ним модель, придавая разным регионам в сердце соответствующие значения проводимости. Настраивая электрофизиологию под конкретного пациента, можно визуально рассчитать эффективность применения целого ряда препаратов»,— рассказала первый автор статьи Анастасия Синицына, инженер лаборатории экспериментальной и клеточной медицины МФТИ.
В этой работе ученые сравнили влияние антиаритмического препарата Верапамил, одного из самых распространенных и популярных лекарств, на проводимость в моделях предсердий с различной электрофизиологией и распределением фиброза.
«С помощью индивидуальной модели предсердий мы смогли точно определить, насколько Верапамил подойдет конкретному пациенту или, возможно, менее популярное лекарство будет эффективней. Исходя из анамнеза, конкретного предсердия конкретного пациента, мы можем скорректировать электрофизиологию. Определить, какие проводимости у него нарушены, что мы можем подкорректировать и определить, какой препарат назначить относительно приема других лекарств»,— подчеркнула Анастасия Синицына.
Таким образом, цель исследования — получить реконструкции предсердий пациентов по данным МРТ с наличием и отсутствием наложенного фиброза для сравнения условий фибрилляции на фиброзном субстрате при длительном течении заболевания и на начальной стадии.

