
Ноебелевские лауреаты по химии 2019 (слева направо): Стенли Виттингхем, Джон Гуденаф, Акира Йосино. © Niklas Elmedhed / Nobel Media
В 2019 году премию памяти Альфреда Нобеля присудили за разработку литий-ионных аккумуляторов. В равных долях вознаграждение в 9 миллионов шведских крон разделят Джон Гуденаф (John Goodenough) из университета Техаса в Остине, Стэнли Виттингхэм (Stanley Whittingham) из Университета Бингемтона, США, и Акира Ёсино (Akira Yoshino) из корпорации Asahi Kasei и Университета Мейдзё.
Литий-ионные аккумуляторы есть практически у каждого человека на планете, спектр применения — от источника питания смартфонов до электромобилей и электростанций возобновляемых источников энергии. Давайте разберемся с прошлым, настоящим и будущим батареек в мировом и российском масштабах.
Революция и обратный ход истории
Химические батареи начали использовать более двухсот лет назад. И важным их применением были первые электромобили. Внутри пионерских электрокаров находились свинцово-кислотные аккумуляторы. Накопители энергии того времени обладали маленькой емкостью и быстро деградировали, то есть теряли емкость после нескольких циклов зарядки-разрядки.

В 1898 году отечественный изобретатель Ипполит Романов собрал машину на два человека способную разгоняться до отметки 37.4 км/ч
Основной вклад нобелевских лауреатов в историю накопителей электроэнергии был в том, что они нашли материалы электродов, которые позволили собрать достаточно емкий, перезаряжаемый и долговечный (в смысле количества перезарядок) аккумулятор. Эти характеристики сделали возможными создание и развитие электроники в том виде, к какому все уже привыкли, — карманные телефоны, умные браслеты и роботы-пылесосы.
А еще именно развитие литий-ионных батарей дало второй шанс экотранспорту. Сто лет назад электромотор проиграл битву топливному двигателю, сегодня есть все шансы на реванш.
Два катода и анод
Идея литий-ионных накопителей электрической энергии зародилась давно. Первые исследования в этой области датируются 1912 годом и связаны с именем Гилберта Льюиса (G. N. Lewis). Интересно, что тогда концепцию считали развлечением для фундаментальных исследователей.
Джон Гуденаф предположил, что катод будет давать больший потенциал, если использовать оксиды вместо сульфидов. В 1980 году он продемонстрировал, что оксид кобальта с интеркалированным (помещенным в кристаллическую структуру в результате химической реакции) литием может иметь большую емкость и более высокий потенциал. Так удалось сделать мощный аккумулятор с разностью потенциалов около четырех вольт.
Используя идею Гуденафа в качестве основы, Акира Ёсино в 1985 году создал первый коммерчески успешный аккумулятор. Вместо литиевого металлического анода он использовал материал на основе нефтяного кокса, графитоподобного материала материал, который, как и оксид кобальта в катоде, мог принимать ионы лития в свою структуру в результате химической реакции.
Получился легкий и безопасный аккумулятор, который можно перезаряжать сотни раз. Свойства материалов катода и анода, открытые и исследованые нобелевскими лауреатами, позволили запасать достаточное количество энергии, чтобы удовлетворить потребности развивающейся и жаждущей автономного питания электроники.
Внутри аккумулятора
В процессе разрядки литий-ионного аккумулятора положительно заряженные ионы лития движутся от анода к катоду через электролит, а электроны — по электрической цепи. Получаемая в этом процессе полезная энергия идет на питание смартфона, фитнес-браслета или электробуса.
Батарея разряжена — это значит, большая часть ионов лития уже вкатоде, и остаточное напряжение уже не может создавать достаточный ток. Дальше черед зарядки: под воздействием внешнего электрического поля розетки литий с катода переходит обратно на анод. Когда большая часть ионов вернулась, напряжение ставится достаточно высоким: аккумулятор заряжен.
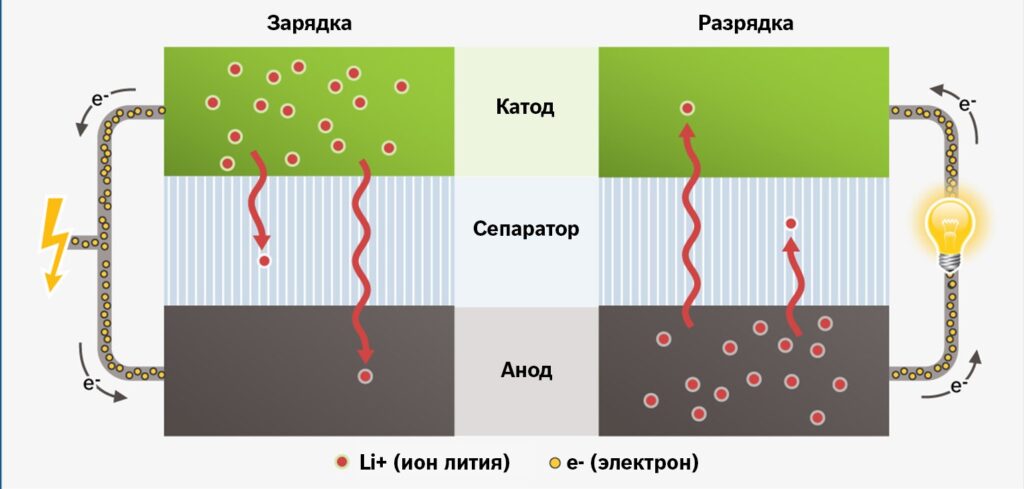
Принцип работы литий-ионного аккумулятора
Разные катоды
Сегодня накопители делают двух основных типов: из литий-кобальт-оксидных и литий-железо-фосфатных (более позднее предложение Гуденафа) катодов. Первые преимущественно служат источником энергии для электроники, вторые питают электротранспорт.
Такое «разделение труда» вызвано в большей степени стоимостью: аккумуляторы первого типа стоят около 250 долларов за киловатт-час, а железо-фосфатные — примерно в 1,5 раза дешевле из-за входящих в их состав более доступных материалов.
Топовые электромобили, например, Tesla или Audi ездят на таких же аккумуляторах, которые используются в смартфонах, — то есть на литий-кобальт-оксидных. А московские голубенькие электробусы на морозоустойчивых и быстрозаряжающихся литий-титатнатных.
Коммерциализация транспорта в России идет медленно. По словам Дмитрия Семененко, заведующего лабораторией накопителей энергии в МФТИ, аккумулятор для электробуса стоит как два-три обычных бензиновых или газовых автобуса. Причина не только в новизне. У нас в стране аккумуляторы не производят и их надо закупать из Японии.
Быстрее, еще быстрее
Для электротранспорта хотелось бы, чтобы мы могли заряжать автомобиль примерно с такой же скоростью, как заправляем бензином. А еще здорово было бы хотя бы сравнять пробеги при полной заправке и полном заряде.
В гаджетах технология быстрой зарядки уже реализована, но у электромобилей очень большой аккумулятор. Чтобы быстро заряжать электромобили один за другим, нужно где-то такую большую энергию предварительно запасать — из обычной электросети достаточное количество получить проблематично. Поэтому для нужд электротранспорта требуется не только быстрая зарядка самих машин, но еще и быстрая разрядка аккумуляторов на зарядной станции.

Станция зарядки электромобилей
Перенос атомов лития между катодом и анодом при зарядке / разрядке — упрощенная модель описания работы литий-ионного аккумулятора. По словам Дмитрия Семененко, при зарядке и разрядке происходит больше 10 различных химико-физических процессов. Каждый из них — источник электрического сопротивления, которое в первую очередь влияет на скорость зарядки и разрядки аккумулятора. Соответственно, фундаментальное решение проблемы ускорения перезарядки аккумуляторов — это поиск принципиально новых материалов, в которых такое сопротивление будет минимизировано.
Нужно больше энергии
Исследователи ищут для аккумуляторов способы запасать больше энергии и повышать ресурс — количество циклов заряда / разряда. Для этого материаловеды разрабатывают новые катоды и аноды, химики — новые электролиты.
Одна из основных причин деградации аккумуляторов — пассивация и разрушение анода. При реакции углеродного материала с литием помимо основного процесса (накопления ионов), происходят несколько побочных. Это когда со временем — после сотен циклов жизни — электроды покрываются пленками продуктов химических реакций, часть лития теряется, а сопротивление сильно возрастает. Поэтому эффективность аккумулятора сильно снижается. Чтобы решить эту проблему, ученые ищут новые составы электролита, в котором пассивации не происходило бы.
Прошлое, настоящее и будущее
В истории развития литий-ионных батарей технологическое развитие идет в ногу с фундаментальными исследованиями. Батарея, изготовленная Виттингхэмом в 1973 году, обладала энергетической емкостью 45 ватт-час. С того момента энергетическая плотность — киловатт-часы на единицу массы — увеличилась в 4-5 раз. Согласно комментарию Дмитрия Семененко, в ближайшие 10 лет этот параметр можно увеличить еще в 1,5 раза.
В Азии литий-ионные накопители энергии развивают для нужд электроники, в Европе и Америке — для электротранспорта и сетевой электроэнергетики. При этом исследования и разработка технологий идут как на уровне коммерческих компаний, так и в масштабе фундаментальных исследований при университетах.
Начало коммерческого пути литий-ионных аккумуляторов пришлось как раз на момент распада Советского Союза, и эта отрасль в российской науке по большому счету даже не зародилась. Поэтому у нас аккумуляторные технологии развиваются с оглядкой на передовые мировые научные центры.
В МФТИ благодаря Федеральной Арктической программе и проекту «Автономная энергетика арктического региона» исследователи ищут решения, которые позволят обеспечивать регион энергией без завозного топлива. Возобновляемые методы генерации электроэнергии — ветряной или солнечный — нерегулярны и требует накопителей.
Сейчас в России есть несколько лабораторий по разработке современных аккумуляторов. Причем, как рассказал нам Дмитрий Семененко, в МФТИ разрабатываются батареи на основе других технологий, чтобы можно было удешевить производство и организовать его в России.
Дмитрий Семененко, заведующий лабораторией накопителей энергии в Институте арктических технологий МФТИ:
— Догнать и победить китайцев в борьбе за цену в сегодняшних технологиях — это задача совершенно нерешаемая. Мы работаем над так называемыми постлитий-ионными технологиями. Если сделать что-то новое, перспективное и начать его производить — это как раз тот путь, которым можно идти, и мы ему следуем.
Секретный ингредиент
Электроды, которые сегодня используют в аккумуляторах, делаются по более-менее универсальному «рецепту»: литий-оксид или литий-фосфат-железные катоды и углеродосодержащий анод. Однако в игре есть третий важный компонент— электролит. Именно он отвечает за успешный переход атомов лития между электродами в процессах перезарядки. И именно он в состоянии значительно влиять на характеристики аккумуляторов.

Lithium-ion battery — литий-ионный аккумулятор, Cathode — катод, Electrolyte — электролит, Li-Metal Oxides — литий-металл оксид, Separator — разделитель, Graphite — графит, Anode — анод. Источник: kuzov-media.ru
Электролит — многокомпонентная система, в которую могут входить до 20 различных веществ. Строго общепризнанного состава нет, у каждой коммерческой компании свой рецепт.
«TESLA декларирует для аккумулятора несколько тысяч циклов перезарядки, а от самого дешевого из магазина не стоит ждать больше сотни. В том числе потому, что в дорогих аккумуляторах используется секретный многокомпонентный электролит, который обеспечивает большой ресурс, а в дешевых — самый простой, лишь бы было напряжение и шел ток», — пояснил Дмитрий.
Благодаря реализации идей нобелевских лауреатов технология, которая сто лет назад казалась теоретическим развлечением, сегодня доступна большей части населения планеты: наверняка, у читателя есть хотя бы одно устройство, питающееся от «нобелевского» аккумулятора. Литий-ионные батареи обеспечили революцию в области портативной электроники. Рынок аккумуляторов оценивается сегодня в 38 миллиардов долларов и явно не собирается сбавлять обороты.
2

