
На фотом (слева направо): Валентин Борщевский, Иван Гущин и Павел Буслаев, сотрудники Центра исследований молекулярных механизмов старения и возрастных заболеваний МФТИ
Ученые из МФТИ в сотрудничестве с коллегами из исследовательского центра Юлих, Института структурной биологии в Гренобле и Европейского центра синхротронного излучения узнали детали механизма работы «обоняния» бактерий. Это удалось сделать благодаря получению структуры белка NarQ из кишечной палочки — представителя универсального класса сенсорных киназ, отвечающих за передачу сигнала об окружающей среде внутрь бактерий. Работа, опубликованная в журнале Science, поможет понять, как бактерии «общаются» между собой и образуют устойчивые группы на стерильных поверхностях или в организме человека.
Лекарства, влияющие на бактериальное «обоняние» — перспективные заменители современных антибиотиков. Они не убивают бактерии, а лишь подают им сигналы для того, чтобы те стали безвредными для организма. Так как лекарства такого типа не нарушают нормальную жизнедеятельность микроорганизмов, к ним не может выработаться устойчивость, в отличие от классических антибиотиков.
Две компоненты клеточного обоняния
Любая клетка отделена от окружающей среды плотной мембраной, через которую не проходят практически никакие химические вещества. Это позволяет ей держать условия внутри себя постоянными и правильно функционировать. Однако мембрана сильно ограничивает обмен информацией с окружающей средой. Для того, чтобы узнавать о происходящем снаружи, клетка использует особые молекулярные машины — белки. Те из них, что предназначены для общения с окружающей средой, чаще всего «живут» прямо в мембране или около нее, и отвечают за передачу сигналов или химических веществ внутрь клетки или наружу.
Наиболее универсальным механизмом «восприятия» окружающей среды у бактерий являются двухкомпонентные регуляторные системы. Такая система состоит из двух белков: киназы, которая принимает сигнал снаружи клетки и передает его вовнутрь, и регулятора, который принимает сигнал внутри клетки и запускает дальнейшие реакции.
Молекулярная фотография
Для понимания работы белков хорошим подспорьем может служить их структура, полученная с атомной точностью. На данный момент большинство белковых структур (более 100 000) получено методом кристаллографии. Суть этого метода заключается в наблюдении картины дифракции от упорядоченных в кристаллическую решетку молекул белка. Однако таким образом можно получить только структуру какого-то одного состояния белка, как на фотографии. Если получится «сфотографировать» начальное и конечное состояния какого-то процесса, можно предположить, как именно работает белок при переключении между этими состояниями.
Мембранные «поршни» двигают/толкают клеточное обоняние
Авторам исследования удалось получить структуру киназы NarQ из кишечной палочки E. coli в двух состояниях. Эта киназа «ощущает» присутствие ионов NO2— и NO3— в окружающей среде и передает сигнал об этом через клеточную мембрану. Оказалось, что белок образует «димер»: два белка работают вместе, чтобы захватить ион. Первое состояние — неактивное, в котором белок не связан с ионом нитрата и не передает никакого сигнала. Второе состояние, напротив, активное, или сигнальное: в нем киназа сообщает внутрь клетки о наличии нитратов в окружающей среде.
Структура белка в сигнальном состоянии была получена для наиболее достоверного «дикого» белка: без искусственных мутаций, которые ученые часто используют для того, чтобы повысить стабильность белка. Для получения структуры в неактивном состоянии авторы мутировали место, к которому привязывается нитрат. При этом стабильность белка не была нарушена, однако нитрат перестал присоединяться к нему, давая возможность посмотреть на киназу в неактивном состоянии.
Выяснилось, что сигнальное и неактивное состояния отличаются в месте связывания нитрата совсем немного, на 0,5-1 ангстрема (примерно одна пятая размера самого иона; 1 ангстрем — 10-10 метра). Однако присоединение этого иона посередине между двумя киназами вызывает каскад изменений в белке: сначала, как поршни, сдвигаются трансмембранные спирали разных мономеров. Эти «поршни» передают небольшое изменение в 0,5-1 ангстрема через мембрану, и их внешние концы при этом раздвигаются на ~2.5 ангстрем в разные стороны. На выходе из мембраны, в НАМР-домене, продольные сдвиги спиралей конвертируются во вращение двух частей сенсора друг относительно друга. Эти сдвиги в итоге изменяют положение спиралей регулятора на целых 7 ангстрем, завершая передачу сигнала.
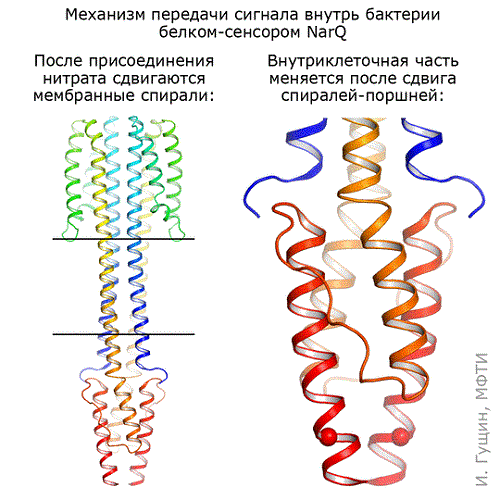
Кроме структур, в которых два белка образуют пару — димер, симметричную относительно центральной оси, ученым удалось получить структуру с асимметричным положением двух белков в паре. В этом состоянии белок «уложен» в кристалле иначе и сильно изогнут. Однако все спирали смещены так, что воздействие на внутриклеточную часть белка почти не меняется. Подобная универсальность открытого движения позволяет сказать, что механизм передачи сигнала универсален, и для того, чтобы «ощутить» другие химические соединения, достаточно будет изменить только внешнюю часть рецептора, не меняя при этом «поршневой» механизм.
«Передача сигнала через клеточную мембрану — один из фундаментальнейших вопросов современной биологии. В этой работе мы в деталях показали, как сигнал (в данном случае, связывание нитрата) может передаваться на сотни ангстрем внутрь клетки — бактерий и архей, а также грибов и растений. Понимая механизмы передачи сигнала более полно, мы можем рассчитывать в будущем научиться манипулировать такими клетками, и в частности ослаблять или нейтрализовать вредные эффекты патогенных микроорганизмов», — комментирует исследование Иван Гущин, заведующий лабораторией структурного анализа и инжиниринга мембранных систем МФТИ и, на момент написания статьи, также сотрудник Исследовательского центра Юлих.
Работа была выполнена при поддержке гранта ERA.Net RUS PLUS (ID 323) и гранта RFMEFI58715X0011 Министерства образования Российской федерации.

