
Иллюстрация, «Альцгеймер». Дизайнеры Елена Хавина и @tsarcyanide, пресс-служба МФТИ
Ученые из МФТИ и ИБХ РАН на примере одной наследственной генетической мутации раскрыли общие изначальные молекулярные механизмы, которые могут приводить как к преждевременным формам болезни Альцгеймера, так и к связанным с возрастом изменениям в организме человека. Знание этих механизмов необходимо для поиска новых направленных способов лечения данной нейродегенеративной болезни, все более охватывающей «стареющие» развитые страны мира. Результаты работы опубликованы в журнале ACS Chemical Biology.
Деменция — синдром, при котором происходит деградация памяти, мышления, поведения и способности выполнять ежедневные действия. Болезнь Альцгеймера — наиболее распространенная причина деменции, на нее приходится 60–70% всех случаев (согласно докладу ВОЗ). Это ставит ее в ряд социально-значимых заболеваний, на борьбу с которыми выделяются огромные средства — как бюджетные, так и фармацевтических компаний. Болезнью Альцгеймера в возрасте страдали такие известные политики, как Маргарет Тэтчер и Рональд Рейган. Как правило, болезнь обнаруживают у людей старше 65 лет, однако иногда ее диагностируют у людей 40 лет или даже раньше. Примерно 10–15% случаев преждевременной болезни Альцгеймера — результат наследственной генетической предрасположенности, которая со временем приводит к преждевременной патологии. При этом комплексные исследования наследственных, так называемых «семейных», мутаций могут подсказать ключевые механизмы развития болезни Альцгеймера, в особенности ее инициации.
Болезнь Альцгеймера сопровождается скоплением в тканях мозга амилоидных бляшек, которые образуются из патогенных форм β-амилоидных пептидов. Эти пептиды представляют собой короткие (около 40 звеньев в аминокислотной последовательности) фрагменты белка АРР (amyloid precursor protein), пронизывающего насквозь мембрану клеток мозга. В процессе жизнедеятельности нейронов происходит расщепление белка АPР различными ферментами. Если «большой» белок APР (биологическая функция которого до сих пор до конца не понятна) последовательно «разрежут» ферменты β- и γ-секретаза, то образуются β-амилоидные пептиды, которые в небольшом количестве необходимы, по-видимому, для поддержания работы мозга. Однако γ-секретаза последовательно разрезает цепь белка APP (внутри мембраны нейронов) на фрагменты с чуть различной длиной.Так возникают относительно «непатогенные» и «патогенные» формы β-амилоидных пептидов. Основная патогенная форма состоит из 42 аминокислотных остатков (Aβ42), в то время как менее патогенная форма — из 40 (Aβ40). У здоровых людей соотношение Aβ42/Aβ40 невелико, примерно 1/9. Большее численное отношение Aβ42/Aβ40 говорит об избыточном производстве Aβ42, что приводит к патологии. На сегодняшний день учеными проверяется гипотеза, что β-амилоидные пептиды являются активными молекулами врожденного иммунитета нервной системы человека, а их интенсивное выделение связано с различными воспалительными процессами и повреждениями тканей мозга. В то же время большинство семейных мутаций в последовательности белка APР, с которыми связывают преждевременное развитие болезни Альцгеймера, найдены в мембранной области этого белка.
Целью данной работы стало изучение наследственной «Австралийской» мутации (L723P) в мембранном сегменте белка АРР, которая ассоциирована с ранним развитием болезни Альцгеймера. Ученые исследовали структурно-динамическое поведение мутантной формы мембранного фрагмента белка APР в сравнении с его немутантной формой при помощи методик белковой инженерии, спектроскопии ядерного магнитного резонанса (ЯМР) высокого разрешения и компьютерного моделирования. С помощью ЯМР-спектроскопии была исследована мутантная форма пептида APР в сравнении с немутантной по таким параметрам, как распределение «спиральности» аминокислотной цепи, ее стабильность и гибкость, а также доступность цепи для липидов и молекул воды. Исследователи обнаружили, что мутация L723P локально разворачивает концевой виток спирали мембранного сегмента белка APР, а также выпрямляет и стабилизирует сам сегмент в центре липидной мембраны. Кроме того, было замечено, что мутация повышает доступность этого сегмента для молекул воды, что сдвигает «рамку» его расщепления ферментами. Таким образом идет переключение между патогенным и непатогенным каскадами расщепления белка АРР: растет отношение Aβ42/Aβ40, и общая концентрация β-амилоида в тканях мозга увеличивается.
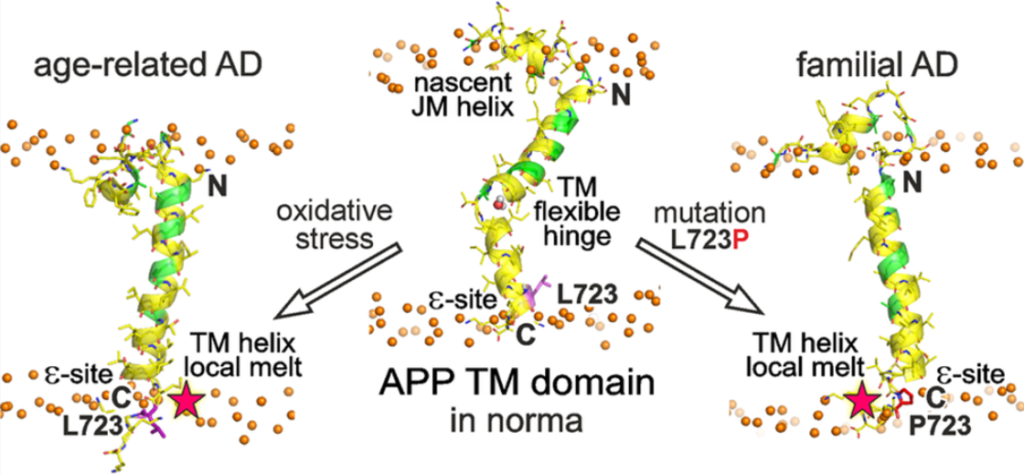
Иллюстрация молекулярных основ патогенеза наследственных и возрастных форм болезни Альцгеймера. Источник: Eduard V. Bocharov et al.; ACS Chemical Biology.
Эдуард Бочаров, старший научный сотрудник лаборатории биомолекулярной ЯМР-спектроскопии ИБХ РАН и лаборатории старения и возрастных нейродегенеративных заболеваний МФТИ, поясняет: «Конечно, данная работа затрагивает только часть причин многосторонней болезни Альцгеймера, молекулярными механизмами патогенеза которой занимаются во множестве лабораторий мира. В том числе интенсивно исследуется основной „игрок“ — мембранный белок АРР — и его последовательное расщепление секретазами в мембране нейронов. Нами был описан каскад событий, происходящих внутри и вблизи клеточной мембраны в момент разрезания белка АРР ферментативным γ-секретазным комплексом. Таким образом, на примере одной „Австралийской“ мутации раскрыты молекулярные основы патогенеза, которые могут приводить как к преждевременному развитию Альцгеймера, так и к формам болезни, связанным с возрастными изменениями в организме человека».
Результаты исследования раскрывают простой молекулярный механизм развития болезни Альцгеймера, связанный непосредственно с влиянием «Австралийской» мутации на структурно-динамические свойства мембранного сегмента белка APР. Это и приводит к пагубному расщеплению белка АРР ферментами-секретазами и интенсивному накоплению патогенных форм β-амилоида вокруг нейронов. Примечательно, что возрастное развитие болезни Альцгеймера можно объяснить схожими механизмами, где вместо мутации будут действовать, например, окислительный стресс или определенный липидный состав мембран нейронов, включающий избыток холестерина. Детальное понимание молекулярных механизмов, регулирующих образование амилоидогенных пептидов, необходимо для создания новых целенаправленных способов лечения, влияющих непосредственно на первичное звено патогенетического процесса болезни Альцгеймера.

