
Дизайнер: Дарья Сокол, пресс-служба МФТИ
В работе, опубликованной в журнале Current Opinion in Structural Biology, биофизики из МФТИ рассказали, как увидеть мембранные рецепторы в разных состояниях. Детальная информация о структуре и динамике таких белков позволит создавать эффективные и безопасные лекарства от многих заболеваний.
Клетки живых организмов ежесекундно получают огромное количество сигналов из окружающей их среды. Большая часть сигналов передается с помощью особых молекул-регуляторов, например гормонов. Большинство сигнальных молекул не имеют способности проникать через плазматическую мембрану клетки, поэтому распознавание многих сигналов происходит непосредственно на плазматической мембране. Для этого на ней расположены молекулы мембранных белков-рецепторов.
Мембранные рецепторы — молекулярные «переводчики» сигнала с «внеклеточного языка» на внутриклеточный. Функционирование мембранных рецепторов жизненно важно для клеток и организма в целом. При нарушении работы рецепторов возникает ситуация, в которой клетки перестают понимать друг друга, что приводит к заболеваниям организма.
Одной из разновидностей мембранных рецепторов являются рецепторы, сопряженные с G-белком (GPCR — G protein-coupled receptors). В основе структуры всех представителей данного семейства лежат семь спиралей, пронизывающих плазматическую мембрану (рисунок №1). Внутри клетки с таким рецептором связывается G-белок. При взаимодействии сигнальной молекулы с рецептором происходит изменение трехмерной структуры (конформации) рецептора, что приводит к активации G-белка. Активированный G-белок, в свою очередь, запускает сигнальный каскад внутри клетки, который приводит к ответу на сигнал.
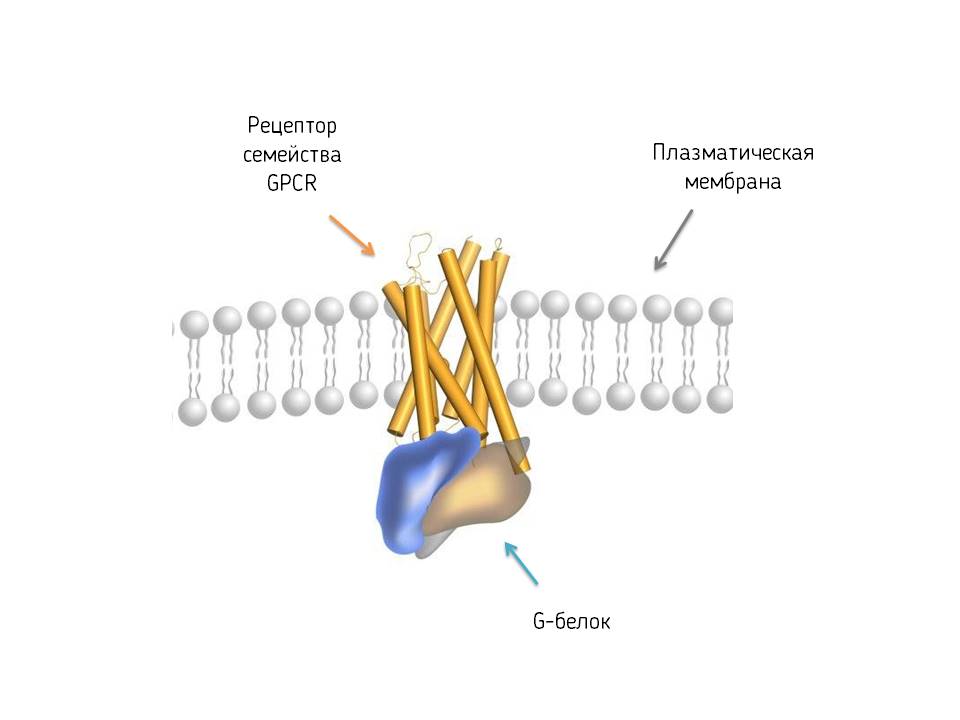
Общий вид GPCR, связанного с G-белком. Источник: Анастасия Гусач©

Основные рецепторы семейства GPCR, связанные с заболеваниями. Источник: Анастасия Гусач©
Один из современных подходов в разработке лекарств основан на исследовании трехмерной структуры молекул GPCR. Но в случае мембранных рецепторов их применение представляет собой долгий и крайне трудоемкий процесс. И даже в случае успеха полученные данные не отражают всей картины поведения молекулы в клетке.
«Перед учеными сейчас стоит выбор: “заморозить” белок в одном состоянии и получить точный “моментальный снимок” либо же увидеть его в динамике, но “размыто”. В первом случае используется кристаллография или криоэлектронная микроскопия, во втором — спектроскопические методы», — комментирует Анастасия Гусач, научный сотрудник лаборатории структурной биологии рецепторов, сопряженных с G-белком МФТИ.
Авторы работы показали, как, скомбинировав два подхода — структурный и спектроскопический — получить наиболее точную информацию о механизмах работы белков семейства GPCR (рисунок №3). Так, методы электронного парамагнитного резонанса (DEER) и Фёрстеровского резонансного переноса энергии (FRET) выступают в роли «атомной линейки», обеспечивая точные измерения расстояния между отдельными атомами и их группами в белке. Метод ядерного магнитного резонанса (NMR) позволяет увидеть общую форму молекулы рецептора, а модифицированные методы масс-спектрометрии (HRF-MS, HDX-MS) — проследить доступность отдельных групп атомов белка для растворителя, понять, какие части молекулы выдаются наружу.
«Для исследования динамики работы GPCR используются самые современные экспериментальные биофизические методы исследований — спектроскопия ядерного магнитного резонанса (ЯМР), спектроскопия электронного парамагнитного резонанса (ЭПР) и методы продвинутой флуоресцентной микроскопии, в том числе микроскопии одиночных молекул», — говорит Алексей Мишин, заместитель руководителя лаборатории структурной биологии рецепторов, сопряженных с G-белком МФТИ.
«Биофизики, изучающие работу GPCR с помощью различных методов, сейчас всё больше сотрудничают, организуя большие и продуктивные коллаборации. Мы надеемся, что этот обзор позволит различным специалистам в своих методах найти больше точек соприкосновения и в итоге получить более полное представление о жизни рецепторов», — дополняет Анастасия Гусач.
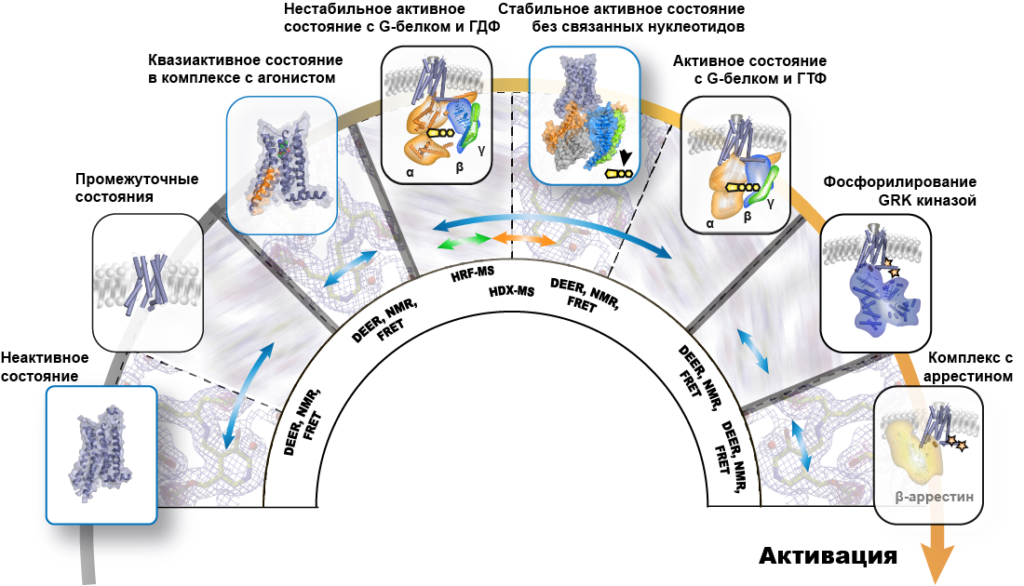
Последовательность процессов, происходящих при активации рецептора семейства GPCR. Источник: Anastasiia Gusach, Current Opinion in Structural Biology
Полученная подробная информация о «жизни» мембранных рецепторов GPCR, об их переходах между различными состояниями с атомной точностью существенно расширяет возможности для рационального дизайна лекарств (structure-based drug design).
Работа выполнена при поддержке Российского фонда фундаментальных исследований и Российского научного фонда.
1

