Тканевая трансглутаминаза (tTG) — это сложный многофункциональный фермент, который имеет важное значение для многих физиологических процессов и участвует в патогенезе ряда заболеваний, включая целиакию. В недавнем исследовании ученые из МФТИ совместно с коллегами впервые разработали полную 3D-модель атомарного разрешения tTG человека и с помощью компьютерного скрининга создали библиотеку новых потенциальных ингибиторов фермента. Полученные данные открывают новые возможности для разработки лекарств от непереносимости глютена. Работа опубликована в журнале Scientific Reports.
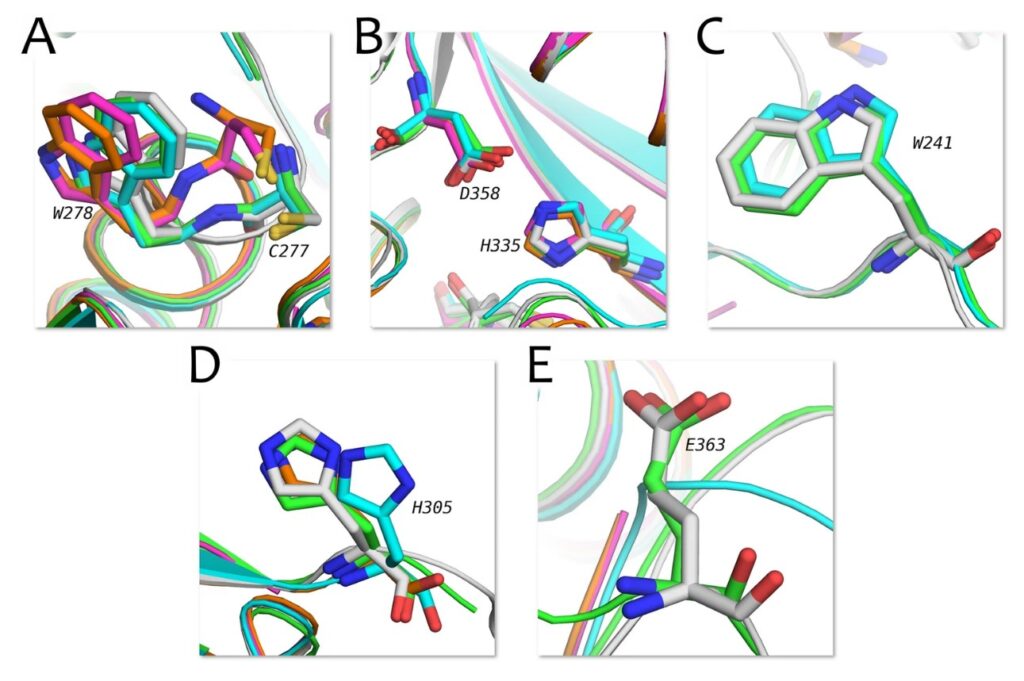
Расположение аминокислотных остатков активного сайта tTG в известных экспериментальных структурах (цветные) и предсказанной в этом исследовании (серым). Источник: Scientific Reports.
Основная задача фермента tTG в клетке — ускорение образования связей между белками, богатыми глутамином и лизином. Белок tTG играет ключевую роль в молекулярном механизме развития целиакии — аутоиммунного заболевания, обусловленного непереносимостью продуктов, содержащих глютен, — что делает его важной терапевтической мишенью.
«Объект нашего исследования выбран не случайно. Целиакия — это довольно распространенное заболевание. Согласно статистике, оно встречается примерно у каждого 100-го человека на планете. Один из соавторов статьи, Владимир Иващенко, является носителем этой болезни, поэтому для нашей группы задача найти подход к облегчению симптомов или лечению целиакии сверхактуальна», — поделился Сергей Иващенко, инженер лаборатории молекулярной и клеточной биологии и оптогенетики МФТИ.
Этот фермент может существовать в двух формах — «открытой» и «закрытой», в зависимости от внешних условий. Именно «открытая» форма участвует в модификации пептидов глютена, что приводит к воспалению. На данный момент на рынке доступны препараты, которые лишь косвенно влияют на активность tTG, в то время как специфические ингибиторы пока не получили широкого распространения. Перспективными прототипами лекарств считаются необратимые ингибиторы tTG на основе пептидомиметиков. Один из таких препаратов, ZED1227, успешно прошел клинические испытания фазы 2а для лечения целиакии, продемонстрировав свою безопасность и подтвердив целесообразность использования tTG в качестве лекарственной мишени.
Современные методы разработки лекарств зачастую включают стадию компьютерного (in silico) анализа — высокопроизводительного докинга, для которого решающее значение играет качество трехмерной структуры изучаемой мишени. Ученым из МФТИ удалось предсказать с помощью нейросети AlphaFold полную 3D-модель tTG в открытой конформации, которая была подтверждена результатами молекулярного докинга и моделирования молекулярной динамики. Полученная структура не только уточняет положение критически важных для активности фермента аминокислотных остатков, но и описывает ранее неизвестное положение остатков вблизи активного центра.
«Предыдущие структуры tTG были разрешены лишь частично (т. е. содержали “пустоты”, в том числе, в активном сайте фермента), что не позволяло корректно применять методы компьютерного моделирования. Наша структура — это первая полная модель tTG, которая содержит дополнительную петлю, оказывающую влияние на эффективность связывания лигандов», — пояснил Сергей Иващенко.
На основе созданной модели фермента ученые собрали библиотеку новых потенциальных ингибиторов tTG, предложенных к дальнейшей экспериментальной проверки. Эти соединения — малые молекулы, большинство из которых не были известны ранее и демонстрируют более высокую аффинность к tTG in silico по сравнению с уже известными. Среди найденных соединений было выделено 12 скаффолдов (молекулярных каркасов) Бемиса-Мурко, один из которых соответствует пептидомиметикам, а три других каркаса показали наилучшие результаты связывания с мишенью. Благодаря большей биодоступности небольшие молекулы могут стать успешной альтернативой пептидомиметикам-ингибиторам tTG.
Таким образом, полученные результаты важны как для фундаментальных исследований, связанных с изучением структурно-динамических особенностей tTG, так и в прикладных целях, существенно расширяя спектр соединений, обладающих высоким потенциалом для эффективного лечения заболеваний, ассоциированных с tTG.
Работа выполнена совместно учеными из МФТИ, МГУ им. Ломоносова, ФГБОУ ВО «РОСБИОТЕХ» и ОИЯИ (Дубна) при финансовой поддержке Министерства науки и высшего образования Российской Федерации (грант 075-15-2021-1354).

