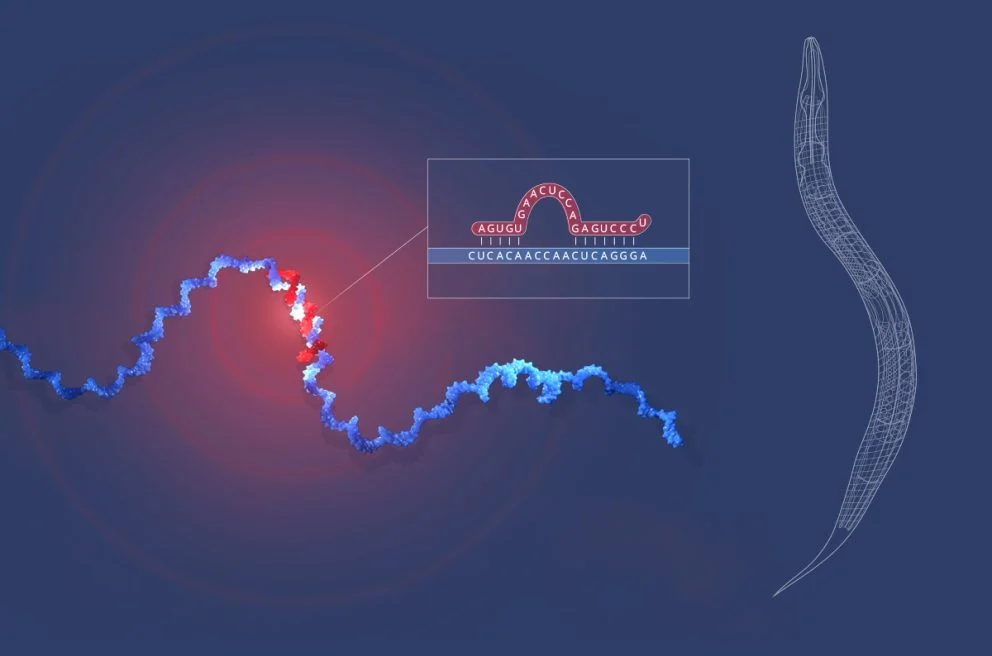
Червь C. elegans (справа) и его взаимодействие микроРНК lin-4 (красная) c фрагментом мРНК lin-14 (синяя). / © The Nobel Committe for Physiology or Medicine. Ill. Mattias Karlén
Нобелевскую неделю 2024 года открыли оглашением имен ученых, которые получат высшую награду в области наук о жизни. Ими стали Виктор Эмброс (Victor Ambros) и Гэри Равкан (Gary Ruvkun) — ученые из США, которые удостоились этой чести за «открытие микроРНК и ее роли в посттранскрипционной регуляции экспрессии генов». Этот класс биомолекул оказался основой нового принципа генетической регуляции, чрезвычайно важного для развития всех многоклеточных организмов и их жизнедеятельности в целом.
Догма и её молекулы
В 1958 году Фрэнсис Крик, уже описавший структуру ДНК (но пока не получивший за это Нобелевскую премию), сформулировал Центральную догму молекулярной биологии. Она гласила: генетическая информация направленно передается между биомолекулами: от ДНК к РНК и далее белкам. Те, в свою очередь, уже занимаются исполнением разнообразных биологических функций. Производство новых копий ДНК называется репликацией, процесс синтеза РНК на матрице ДНК — транскрипцией, а синтез белков на основе РНК — трансляцией.
Как это нередко бывает в биологии, оставалась неизменной эта схема недолго. Всё оттого, что РНК на самом деле представлена разными классами, играющими различные роли в клетке и далеко не всегда кодирующими белки. РНК из криковской схемы мы сегодня называем матричными (мРНК) — их последовательность действительно служит инструкцией, матрицей для синтеза белка на рибосоме. В той же трансляции принимают участие рибосомальная РНК (рРНК) — структурная основа и «рабочая поверхность» этой фабрики по производству белков, а также приносящие к ней новые аминокислоты транспортные РНК (тРНК). Последние описали в 1964-м, а премию за них дали по нобелевским меркам моментально — в 1968-м. Все они хорошо вписывались в Центральную догму и сделали картину подробнее.
Дальше, однако, стало интереснее — была открыта обратная транскрипция, процесс синтеза ДНК на матрице РНК. Нобелевскую премию за ее открытие вручили в 1975 году. А РНК, которые в 1993 году описали Равкан и Эмброс, — это еще одно важное дополнение к картине экспрессии генов. Им, однако, пришлось ждать своей Нобелевки намного дольше.
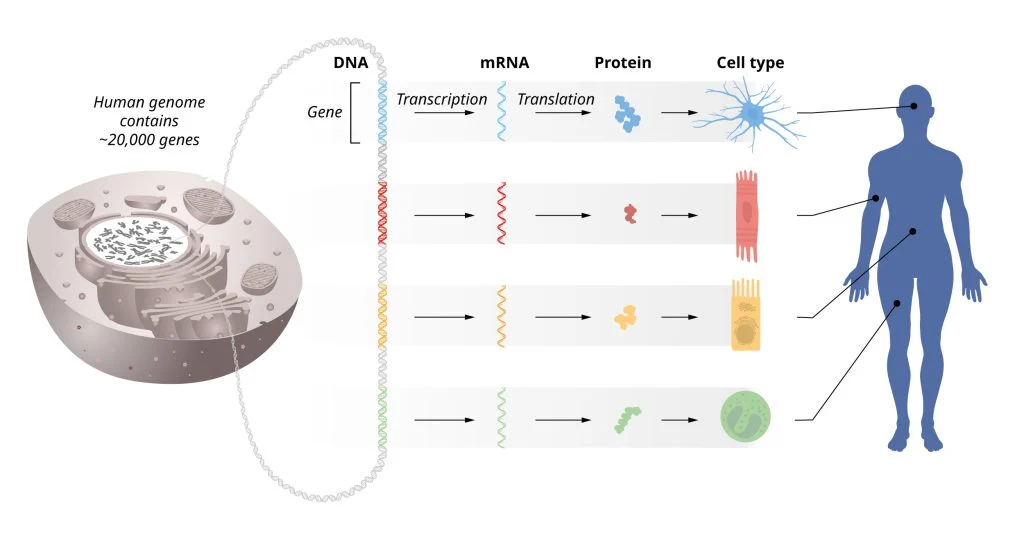
Поток генетической информации от ДНК к РНК и белкам. В ДНК всех клеток нашего организма хранится идентичная генетическая информация. Чтобы в каждом конкретном типе клеток был активен только нужный набор генов, необходимо регулировать их активности. / © The Nobel Committee for Physiology or Medicine. Ill. Mattias Karlén
МикроРНК — короткие, их длина обычно не превышает 21-23 нуклеотидов.
«Некоторые путают микроРНК с мРНК, за применение которой в конструкции вакцин нового поколения премию дали в прошлом году, — говорит Дмитрий Карпов, доцент кафедры молекулярной и клеточной биологии ФБМФ МФТИ. — Но это совсем разные вещи. МикроРНК не кодируют собственные белки и работают только как “наводчики” для механизмов, контролирующих синтез белка и другие клеточные процессы. А мРНК из ковидных вакцин кодируют белки, против которых организм должен выработать антитела, чтобы защищать нас от инфекции. Также микроРНК следует отличать и от так называемых интерферирующих РНК, которые ученые используют, что по своему желанию заставить“молчать” те, или иные гены».
«За открытие РНК-интерференции дали премию в 2006 году, Эндрю Файеру и Крейгу Мелло, — рассказывает доктор биологических наук профессор Константин Северинов. — В своих исследованиях они показали, что ничего не кодирующие двухцепочечные короткие молекулы РНК, введенные в клетку извне, способны влияять на работу генов. Присутствие такой РНК в клетке приводит к тому, что соответствующие им по последовательности клеточные РНК уничтожаются.. Нобелевская премия этого года присуждена по сути за очень похожий процесс, однако с участием собственных, закодированных в геноме клетки малых РНК. Они взаимодействуют с соответствующими им по последовательности нуклеиновыми кислотами, ДНК или РНК, по такому же принципу, как две цепочки ДНК взаимодействуют друг с другом и влияют как на транскрипцию ДНК в РНК, так и на трансляцию РНК в белки. Сейчас понятно, что в ДНК, в частности, в геноме человека, есть очень много участков, которые не кодируют белки, а служат именно источником различных микроРНК, которые влияют на то, как работают “настоящие гены”».
Маленький червь и большие открытия
Исследования свежеиспеченных нобелиатов начались еще в конце 1980-х годов. Тогда Эмброс и Равкан были постдоками, недавно защитившими диссертации и работавшими в лаборатории Роберта Хорвица. Их начальник получил собственную Нобелевскую премию в 2002 году, вместе с Сиднеем Бреннером и Джоном Салстоном — за открытия в области генетического регулирования развития органов и механизмов программируемой клеточной смерти.
Хорвиц с коллегами проводили принесшие свои нобелевские эксперименты на нематодах Caenorhabditis elegans. Этих круглых червей длиной около миллиметра сегодня можно встретить не только в почве, но и во многих биологических лабораториях. Они стали любимыми модельными организмами многих молекулярных биологов и эмбриологов благодаря своим уникальным особенностям. Мы хорошо знаем число клеток в его организме — их всего тысяча (точные значения зависят от пола). Нейроны червя тоже наперечет — ровно 302, причем нам известны все связи между ними (коннектом). Все это делает маленького прозрачного червя прекрасным объектом для изучения развития организма.
Небольшое число клеток не мешает C. elegans иметь различные специализированные ткани — мышцы, нервы, кишечник, половые органы и другие. Они очень похожи на ткани крупных и сложно организованных животных, включая человека. Группа Хорвица, работая с нематодами, имела дело с удивительными мутантами. У одних из них был поврежден ген lin-4 — и такие особи вырастали аномально крупными, причем каких-то типов тканей в их телах не доставало, а других оказывалось в переизбытке. У других мутантов был поврежден ген lin-14, и они напротив, были очень маленькими.
К этому времени биологи уже понимали, что признаки живого организма не сводятся к сумме всех его генов, и клетки приобретают отличия за счет разной активности генов в разных тканях. Исследователи предположили, что мутация в гене lin-4 ломает разворачивание во времени алгоритмов развития червя. И некоторые из них отрабатывают больше циклов, чем должны, а другим наоборот, недостает времени. Может, в случае с мутацией lin-14 ситуация обратная, и это приводит к преждевременной остановке процессов развития?
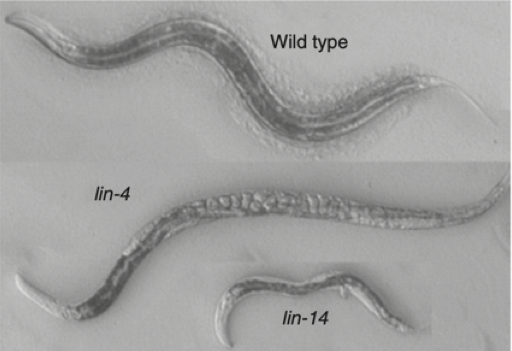
Обычный C.elegans рядом с двумя мутантами
Здесь-то за дело взялись ученики Хорвица: Виктор Эмброс и Гэри Равкан.
Как обычно бывает в таких случаях, «сломанные» гены должны были помочь биологам понять их нормальные функции. Эмброс изучал нематод-гигантов. Равкан же пытался объяснить маленькость мутантных по lin-14 червей.
Эмброс вскоре выяснил точное положение гена lin-4 и понял, что он не кодирует никакого белка: при транскрипции lin-4 получалась слишком короткая для этого РНК, всего 22 пары оснований. А кроме того, lin-4 также подавляет активность гена lin-14. Предстояло выяснить, как именно это происходит.
Равкан исследовал второй ген (lin-14) и показал, что в отличие от lin-4 тот кодирует белок. Однако производство этого белка идёт только на ранних стадиях развития зародыша — на поздних экспрессию lin-14 подавляет тот самый lin-4.
Равкан также выяснил, что lin-4 оказывает свой эффект не путем остановки синтеза мРНК на матрице ДНК lin-14, как это подразумевала Центральная догма. Ученые уже знали, что подобную регуляцию обеспечивают специальные белки — факторы транскрипции, — которые взаимодействуют с ДНК и тем самым меняют экспрессию генов. Их открыли незадолго до того, в 1987 году в геноме кукурузы. Но никакого белка lin-4 не кодирует! Выходит, в этой случае изменения происходили на другом уровне — что-то происходило с мРНК гена, которая перестала быть основой для синтеза белка.
«В последние годы становится понятно, что не все заболевания можно объяснить мутациями в генах, — говорит Валерия Цвелая, заведующая лабораторией экспериментальной и клеточной медицины МФТИ. — Многие из них определяются исключительно транскриптомом (совокупностью РНК) и, как следствие, фенотипом клеток. Именно поэтому некоторые заболевания невозможно диагностировать на ранних стадиях. Решением могут стать микроРНК — в качестве раннего признака заболеваний. Открытые [лауреатами Нобелевской премии] микроРНК вскоре стали очень горячей темой, перспективной для создания платформ ранней диагностики, а возможно даже терапии заболеваний».
Дальше действовать будем мы вместе
Прорыв случился именно тогда, когда обе научных группы объединили свои усилия. Эмброс и Равкан, поделившись друг с другом собранными данными и соображениями, сразу поняли, что короткая последовательность гена lin-4 комплементарна (то есть точно соответствует) конкретному участку матричной РНК гена lin-14. У особей без этого участка lin-14 проблем с синтезом белка из-за lin-4 не возникало. Выходит, что РНК lin-4 (собственно, микроРНК) должна была напрямую связываться с другой, «обычной» мРНК lin-14, останавливая синтез белка.
Предположение подтвердили в эксперименте, тем самым впервые описав принципиально новый механизм регуляции экспрессии генов исключительно за счет РНК. Основополагающие статьи с этими результатами Эмброса, Равкана и их коллег вышли в журнале Cell одновременно в 1993 году.
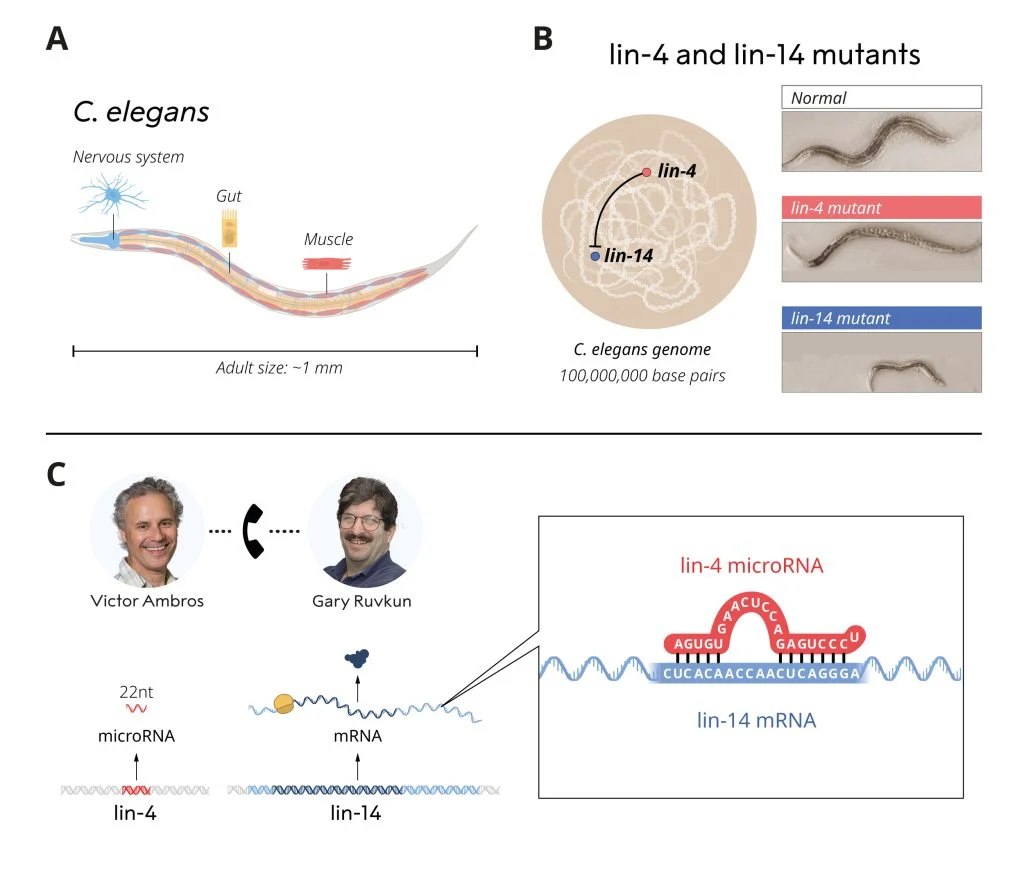
(A) C. elegans (B) Позиции lin-4 и lin-14 и мутантные по этим генам особи (C) Схема экспрессии lin-4 и lin-4 и схема связывания их РНК / © The Nobel Committee for Physiology or Medicine. Ill. Mattias Karlén
Однако научное сообщество встретило их довольно прохладно. Публикации сочли интересными, но сам механизм показался биологам лишь экзотическим примером, причудой генома конкретного червя, которая вряд ли имеет отношение к другим животным, позвоночным и уж тем более человеку. Переменилось мнение коллег только через восемь лет — в 2000 году Равкан описал 21-нуклеотидную микроРНК, которую кодирует ген let-7. Отмахнуться от него уже было невозможно — это высококонсервативный ген, который есть у самых разных животных, включая человека. В каждом случае он имеет очень похожую последовательность, которая мало изменялась в ходе эволюции.
За let-7 последовали множество других микроРНК — сейчас в одном только геноме человека их известно более тысячи. Удалось также выяснить, что такой механизм генной регуляции универсален для всех многоклеточных организмов и имеет особое значения для процессов развития.
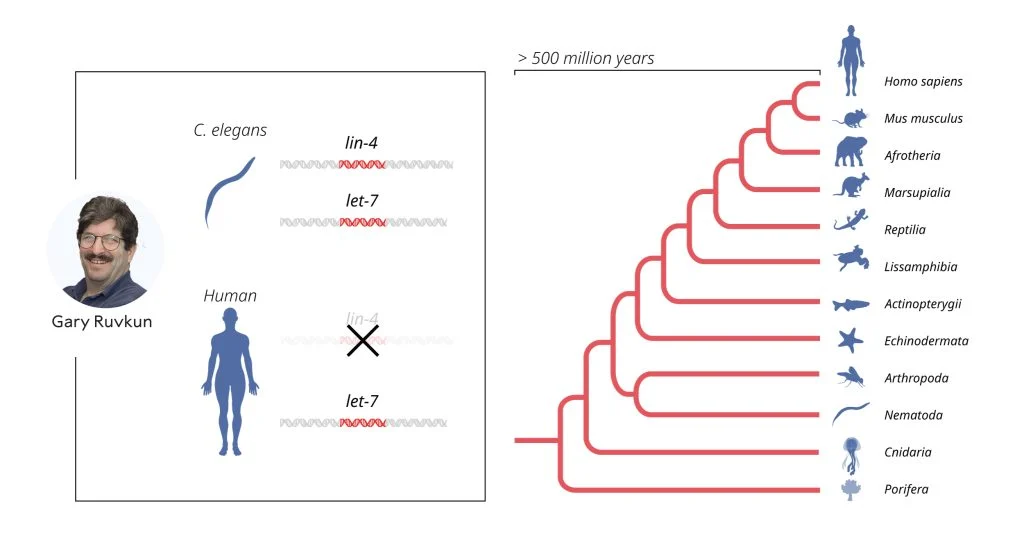
let-7 — еще один ген, кодирующий микроРНК. Этот ген эволюционно консервативен, и теперь мы знаем, что роль микроРНК в регуляции геномов универсальна для многоклеточных организмов. / © The Nobel Committee for Physiology or Medicine. Ill. Mattias Karlén
«Ключевое результат состоит в том, что Центральная догма молекулярной биологии, та, которую мы учили в школе — она неполная, — резюмирует Константин Северинов. — Что она говорит? Что генетическая информации содержится в ДНК. Что ген — это участок ДНК, который кодирует белок, и кодирование белка осуществляется путем транскрипции ДНК в РНК, а затем трансляции РНК в белок, который, в зависимости от последовательности составляющих его аминокислот выполняет различные биологические функции: структурные, каталитические функции насосов, функции движения… и так далее. На этом уровне понимания всё, что нам нужно знать при анализе геномов, например, пациентов, страдающих тем или иным генетическим заболеванием — это какие гены кодируют какие белки, и какие изменения в ДНК приводят и изменениям белков у больных. Но оказывается, возможны ситуации, когда у вас все гены, кодирующие белки, совершенно нормальные, но у организма проблема: червяк не развивается, человек болен. Это происходит сплошь и рядом. Эмброс и Равкан объяснили, почему и как это происходит».
6

