Иллюстрация: Андрей Николаев, аспирант МФТИ
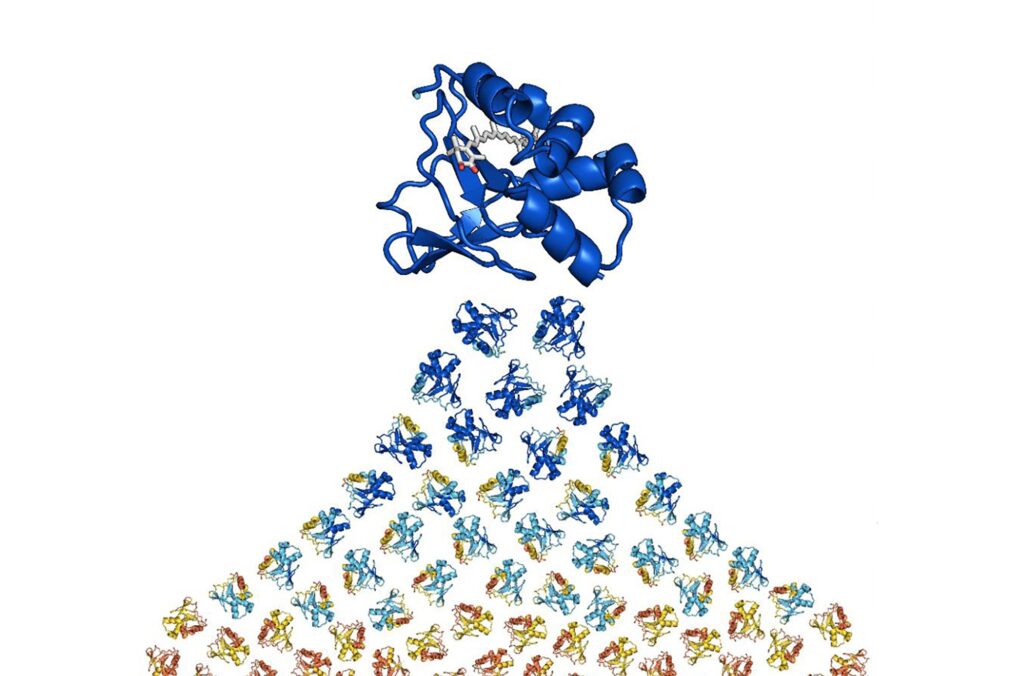
Белок AstaP, впервые найденный в зеленых микроводорослях, связывает каротиноиды — вещества с выдающейся антиоксидантной активностью — и способен переносить их в клетки сетчатки, что в перспективе может помочь защитить ее от возрастных изменений. Однако природный вариант AstaP не является оптимальным для подобной задачи. Сотрудники ФИЦ Биотехнологии РАН, МФТИ и биологического факультета МГУ впервые показали, как при помощи искусственного интеллекта и нейросетей можно изменить структуру белка AstaP, чтобы улучшить его свойства. Важно, что за основу была взята единственная доступная модель структуры белка AstaP, полученная с помощью метода ЯМР-спектроскопии. Свой оригинальный подход реинженерии белков на основе их ЯМР структур исследователи представили в статье на страницах престижного журнала Protein Science.
Нейросети, предсказывающие структуры молекул, переживают настоящий бум: за разработку алгоритма AlphaFold, который предсказывает пространственную структуру белка по его аминокислотной последовательности, а также за подходы к дизайну белков в этом году присудили Нобелевскую премию по химии. Модели машинного обучения помогают «спроектировать на заказ» лекарственные молекулы, растворимые аналоги белков из клеточных мембран, нанопоры желаемой формы и различные ферменты. Алгоритмы MPNN (message passing neural network, что переводится как «нейросеть, передающая сообщения») способны предсказывать последовательность аминокислот в молекуле белка по координатам атомов ее «скелета». «Посоветованные» нейросетью белки часто оказываются более стабильными, растворимыми или простыми в получении. Российские ученые использовали нейросеть этого типа, чтобы улучшить свойства белка AstaP (сокращение от astaxanthin-binding protein, что переводится как «белок, связывающий астаксантин»).
«Недавно мы обнаружили, что антиоксидантное действие каротиноидов, доставляемых природным белком AstaP, снижает вред от гранул пигмента липофусцина. Этот пигмент накапливается в клетках и становится одной из причин возрастной дегенерации сетчатки, ответственной примерно за половину случаев слепоты. Оптимизация структуры AstaP под задачи, связанные с доставкой каротиноидов, в перспективе может помочь пожилым людям сохранять зрение», — поясняет Николай Случанко, заведующий лабораторией белок-белковых взаимодействий ФИЦ Биотехнологии РАН.
Алгоритмы MPNN работают достаточно просто, надежно и быстро, рассчитывая структуры молекул по кристаллографическим данным с точностью выше 50 %. Однако белки AstaP не удается закристаллизовать и таким образом определить их пространственную структуру, а единственная модель структуры этого белка в комплексе с молекулой астаксантина была получена методом ЯМР-спектроскопии.
Авторы исследования предложили новый подход к расчетам, чтобы более эффективно использовать алгоритмы машинного обучения на основе MPNN в работе с данными ЯМР. В результате исследователям удалось создать новые белки, получившие названия NeuroAstaP. Четыре из пяти предсказанных вариантов не только сохранили функциональность природного белка AstaP как «в пробирке», так и внутри клеток, но и обладали рядом преимуществ, в частности, уменьшенным размером, совпадая с последовательностью природного белка только на 40 %.
«В структурах ЯМР, в силу особенностей метода, могут быть некоторые паттерны, затрудняющие использование популярных алгоритмов типа MPNN. До сих пор до конца не понятно, с чем это связано. Нейронные сети в основе популярных алгоритмов для белковой инженерии обычно обучаются на структурах, полученных при помощи кристаллографии и электронной микроскопии. Предложенный нами подход на основе пошагового улучшения численных характеристик моделей и компьютерного подтверждения промежуточных результатов позволяет применять эти же алгоритмы к данным ЯМР без дополнительного переобучения, и тем самым расширяет набор инструментов для рациональной инженерии белковых молекул для применения в задачах медицины и биотехнологии», — подытоживает Иван Гущин, заведующий лабораторией структурного анализа и инжиниринга мембранных систем МФТИ.
2

