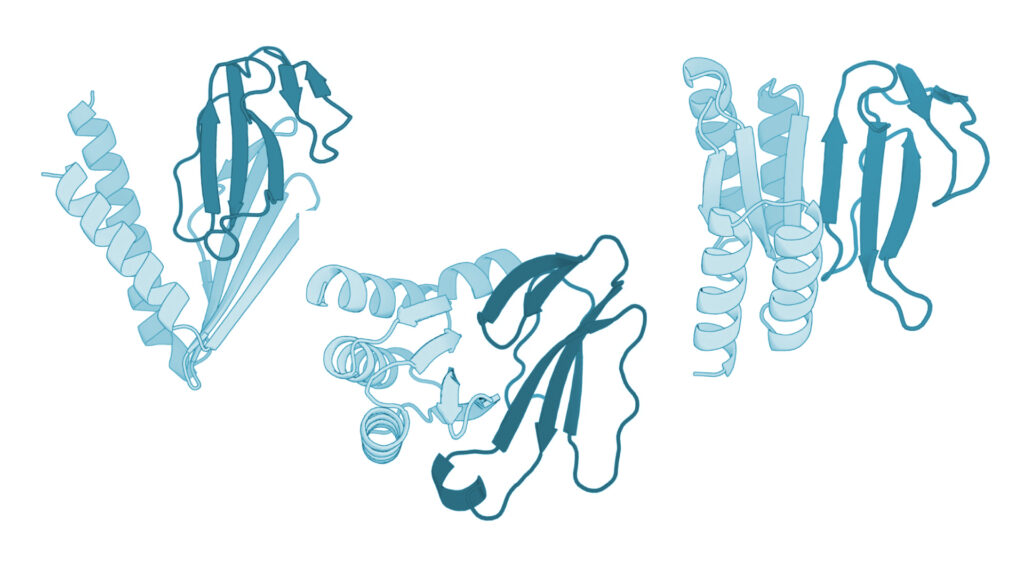
Susana Vázquez Torres et al. / Nature, 2025
Научная группа нобелевского лауреата 2024 года Дэвида Бейкера синтезировала противоядие от змеиных токсинов и испытала его на мышах. Антитоксины, описанные в журнале Nature, были предсказаны при помощи алгоритмов машинного обучения.
Змеиные укусы каждый год убивают сотни тысяч человек по всему миру. По данным ВОЗ, от 81 410 до 137 880 случаев смерти и примерно втрое больше ампутаций и других случаев пожизненной инвалидности. Нейротоксины из змеиного яда приводят к параличу, цитотоксины — к поражениям кожи и других тканей, вплоть до ампутации.
Противоядия от змеиных ядов получают из подопытных животных, например коров или кроликов. Люди вводят в их организм несмертельные дозы змеиных токсинов, чтобы заставить иммунную систему выработать антитела к яду. Затем препарат из крови животных вкалывают людям, укушенным змеёй. Система эта отработанная, но имеет недостатки — дороговизна, риск иммунного ответа в теле пациента на чужеродные антитела, а также проблемы с логистикой. Антитела в тепле портятся, так что их перевозят в морозильниках. Морозильники для хранения биоматериалов — это дорогостоящее оборудование, которое требует, к тому же, бесперебойной подачи электричества. Всё это создаёт трудности в жарких странах, где такие препараты как раз нужнее всего.
К решению проблемы подключился нобелевский лауреат 2024 года Дэвид Бейкер (о нём мы рассказывали в материале «Сложилось как-то так»). В качестве мишени учёные выбрали самые изученные токсины — два нейротоксина из семейства 3FTx. 3FTx, или трёхпальцевые токсины — это основной компонент яда кобры, мамбы и некоторых других опасных змей. Своё название эти токсины получили из-за особой формы молекулы, напоминающей три вытянутых пальца. Нейротоксины 3FTx, попав в организм человека, соединяются с ацетилхолиновыми рецепторами на поверхности нейронов и мышц, блокируют передачу сигналов и вызывают тем самым паралич и смерть от удушья.
Другой целью стал цитотоксин из того же семейства «трёхпалых» — основа яда многих кобр. Цитотоксин связывается с мембранами клеток и попросту разрушает их. Это вызывает тяжёлые повреждения тканей, серьёзные до такой степени, что укус в руку или ногу вполне приводит к её ампутации.
Замысел учёных был таков — разработать и синтезировать с нуля белки, которые будут связываться с трёхпалой молекулой токсина. С этой обузой токсин больше не сможет взаимодействовать с клетками и вредить им. Крепиться белок должен был не к участку, которым токсин связывается с ацетилхолиновым рецептором — так поступают антитела — а с концевыми участками молекулы токсина, делая её совершенно неспособной к какой бы то ни было работе (в силу так называемого стерического затруднения).
Для дизайна белка-антидота учёные использовали несколько вычислительных инструментов. Сперва — RFdiffusion. Этот алгоритм предсказывает форму белка по заданным ему параметрам. В данном случае учёным нужен был белок, который сможет надёжно цепляться к молекуле змеиного токсина и таким образом её инактивировать. Затем они прогнали результаты через ProteinMPNN — метод для расчёта аминокислотной последовательности для белка конкретной формы. Так исследователи выяснили последовательность аминокислот в белковой молекуле антитоксина. Затем они прогнали получившиеся модели-кандидаты через AlphaFold2 и Rosetta. Эти два инструмента проверили, будут ли белки сворачиваться в нужную структуру, и оценили их стабильность и связывающую способность.
В итоге получилось 44 модели-кандидата. Учёные синтезировали необходимую для их кодирования ДНК, внедрили её в дрожжи и синтезировали достаточное для испытаний количество. Из них отобрали два белка — по одному на каждый нейротоксин — и испытали их в пробирке, а затем и на мышах.
«[Оригинальный метод Бейкера] Rosetta — это сложный, основанный на физике подход, — объясняет Иван Гущин, заведующий лабораторией структурного анализа и инжиниринга мембранных систем МФТИ. — Ранее, грубо говоря, предсказывали 10 000 белков, заказывали синтез 10 000 синтетических генов, и из них лишь три в эксперименте работали, как нужно. Соответственно, все радовались что подход работает, но таким не поразбрасываешься, потому что синтез одного гена может стоить десять или двадцать тысяч рублей. Соответственно, синтезировать 10 000 генов будет стоить уже миллион долларов или больше. А протестировать их экспериментально — это, может быть, еще столько же.
А теперь, новые методы [как использовавшиеся здесь RFdiffusion и ProteinMPNN] работают гораздо надежнее. Наши исследования очень близки к этому, и пока опыт такой: мы заказываем три-шесть генов, и половина из них — работают. Или, иногда, все работают. При этом, теперь уже даже не нужны какие-то невероятные вычислительные ресурсы. Эти методы работают на компьютере с видеокартой: когда-то достаточно дня, иногда хватает минуты, иногда нужна неделя, но в любом случае — это уже намного более доступно. Компьютеры с видеокартами, они у многих просто дома стоят.
Последний результат Бейкера — хорошая демонстрация того, что современные методы действительно эффективно работают. Может быть, там и были какие-то специфические трюки или нюансы, но скорее всего они не какие-то критические, и подобное может быть воспроизведено малыми силами даже в небольшой лаборатории, не обладающей ресурсами Бейкера».
Синтетические противоядия оказались очень эффективными. Белки, созданные чтобы связываться с молекулой токсина, связывались как положено, на 10 из 10. Буквально — даже при равных долях антидота и токсина весь яд оказался обезврежен. Испытания на живых мышах тоже показали отличный результат, но при некоторых условиях — пришлось повысить концентрацию противоядия к токсину до 1:10, и вводить лекарство не позднее чем через 15 минут после введения токсина.
В случае с цитотоксином результат был менее впечатляющий, но интересный по-другому. Искусственный белок связывался с молекулой цитотоксина в пробирке очень посредственно — даже при соотношении 1:5 только на 70-90%, тогда как противоядие от нейротоксина связывалось in vitro на 100% при соотношении 1:1. Но и связав большую часть молекул антидот не смог существенно защитить модельные кожные ткани, а до испытаний на мышах дело вовсе не дошло. Зато антидот продемонстрировал новые возможности синтеза иначе.
Учёные планировали «сфотографировать» искусственную молекулу, связанную с белком-токсином, применив рентгеноструктурный анализ. Для этого белки нужно кристаллизовать. Но некоторые участки искусственной молекулы были очень гибкими, и при синтезе располагались как попало, мешая кристаллизации, а значит и рентгеновской кристаллографии. Тогда разработчики добавили в модель ещё один дисульфидный мостик — для крепости. Мостик сработал, и это хорошо, но ещё лучше то, что получившаяся в итоге молекула белка нарушала общие правила структуры белка — у неё не было центрального гидрофобного ядра, каковое положено иметь любому протеину. Потому как фолдинг любого белка должен начинаться с того, что гидрофобные участки белковой нити стремятся убраться подальше от воды, то есть внутрь молекулы.
В общем, публикация в Nature описывает ещё одно успешное применение ИИ для синтеза совершенно искусственных белков с заранее предсказанными свойствами. А неудача с цитотоксиновым антидотом, однако, демонстрирует возможность создавать стабильные белки, которых в природе не то что нет, но и быть не может. Так или иначе, искусственные антидоты Бейкера лучше антител хотя бы своей устойчивостью. Будучи мелкими, в десятки раз меньше чем молекулы антител, они лучше переживают неблагоприятные условия и сохраняют форму, когда антитела расплетаются, агрегируют или выпадают в осадок.
Говорить о том, что машинное обучение полностью «закрыло» область белковой инженерии, все еще очень рано, отмечает Гущин: «Что все уже научились делать при помощи методов машинного обучения — это „кирпичи“, очень твердые белки, которые могут с чем-то накрепко связаться. Как, например, антидоты. А фронтир — дальше: например, ферменты — это более хитрые структуры, очень сложные динамически. Соответственно, нам нужно научить машины предсказывать такие белки, которые будут менять форму, создавать для молекул правильное окружение, заниматься катализом. У того же Бейкера выходят какие-то работы в этом направлении, но они пока очень модельные. И это не то чтобы „сейчас, ребята, подождите немного“, впереди ещё годы работы. Для этого важно научиться моделировать квантовую химию, — но непонятно, поддается ли она на самом деле машинному обучению. Скорее всего, поддается. Важно уметь работать со сложными молекулами. В PDB (Protein Data Bank, крупнейшая открытая база структурных данных о белках, на которой обучаются сейчас алгоритмы машинного обучения) есть информация о том, как расположены в том или ином белке аминокислоты. Каждая запись содержит сто, двести, пятьсот аминокислот. А вот каких-нибудь более хитрых молекул может оказаться пять молекул на весь PDB. Или ноль. Соответственно, даже для AlphaFold предсказывать, например, комплексы белков с маленькими молекулами — проблематично. Недавно выходил очередной препринт, и там качество предсказания для тех молекул, подобных которым в PDB нет, остается пока околонулевым. Поэтому область продолжает привлекать внимание и академических исследователей, и крупных корпораций, а интересные результаты появляются чуть ли не каждую неделю».

