Коллектив ученых из МФТИ разработал метод, позволяющий с высокой точностью идентифицировать наиболее агрессивные раковые клетки, ответственные за распространение метастазов. Работа опубликована в специальном выпуске Advancing Nanotechnology in Cancer Theranostics журнала Life (Impact Factor 3.4, CiteScore 6.0), приглашенным редактором которого является Юлия Мерхер, старший научный сотрудник лаборатории персонализированной химио-лучевой терапии МФТИ. Исследование выполнено при поддержке гранта РНФ.
Ежегодно в мире рак молочной железы диагностируется более чем у 2 млн женщин. Смертельные случаи в основном обусловлены метастазами — миграцией и способностью раковых клеток проникать в окружающие ткани. Например, пятилетняя выживаемость пациентов трижды негативного рака — агрессивной формы — составляет 77%, тогда как для метастатической опухоли этот показатель составляет всего 7–10%.
В итоге ключевой проблемой онкологии является точное прогнозирование вероятности метастазирования. Хотя на практике существует множество надежных методов диагностики, например анализ состояния лимфатических узлов, гистология, размер опухоли и экспрессии генов, важно отметить, что прогностическая способность данных методов лимитирована, что подчеркивает острую необходимость разработки инновационных методов, способных предсказывать метастазирование на ранних стадиях.
В большинстве солидных («твердых») опухолей, включая рак груди, метастазирование происходит посредством коллективной миграции клеток, которые сохраняют связи друг с другом. Во главе группы встают особые клеточные лидеры. Они прокладывают путь, прилагая механические усилия и раздвигая окружающие ткани.
Исследователи установили, что лидеры коллективного движения опухоли активнее поглощают флуоресцентные наночастицы и обладают более упорядоченной внутренней структурой. Обнаружение этих клеток имеет решающее значение для разработки таргетных методов лечения, способных эффективно сдерживать метастазирование.
«Изучением механизмов миграции и инвазии раковых клеток наша лаборатория занимается несколько лет. В предыдущих исследованиях мы разработали новый количественный подход к дифференциации раковых клеток с различным метастатическим потенциалом. Этот метод основан на фундаментальном предположении, согласно которому процессы, происходящие в цитоскелете мигрирующей клетки и эндоцитозе, имеют существенное сходство.
В этой работе мы изучили взаимодействие клеток в процессе метастазирования, определив, что является их движущей силой. Наша главная задача — научиться выделять лидеров клеточного движения и в ходе лечения избавляться конкретно от них. Лидеры генерируют силы посредством актомиозин-опосредованного выпячивания и сократимости.
Актомиозин — комплексный белок мышечной ткани, основной сократительный элемент, обеспечивающий движение, но он также важен для других клеточных процессов, таких как эндоцитоз. Обнаружение и выделение таких клеточных лидеров способно значительно повысить эффективность лечения»,— рассказала об исследовании Юлия Мерхер, старший научный сотрудник лаборатории персонализированной химио-лучевой терапии МФТИ.
Первый автор статьи Анастасия Александрова, студентка Физтех-школы биологической и медицинской физики МФТИ начала заниматься этим проектом в лаборатории персонализированной химио-лучевой терапии в рамках менторской программы.
Анастасия отметила: «В ходе экспериментов мы увидели, что наночастицы действуют подобно метке, подсвечивая именно те клетки, которые берут на себя роль первопроходцев. Это прямое доказательство того, что в них миграционный и эндоцитарный аппараты работают согласованно и эффективно. Именно активные клетки, ведущие за собой миграцию, способны поглощать намного больше наночастиц».
Чтобы понять, как устроен двигательный механизм лидеров, ученые решили заглянуть внутрь клеток. С помощью фаллоидина, вещества, которое избирательно связывается с актиновыми нитями, они визуализировали цитоскелет. Анализ изображений показал существенные различия между лидерами и другими клетками сообщества. Актиновые филаменты в лидерах были гораздо более упорядоченными и выстроенными в одном направлении, что отражалось в высоком коэффициенте анизотропии. В то же время клетки с низким двигательным потенциалом демонстрировали хаотичную, беспорядочную структуру актина.
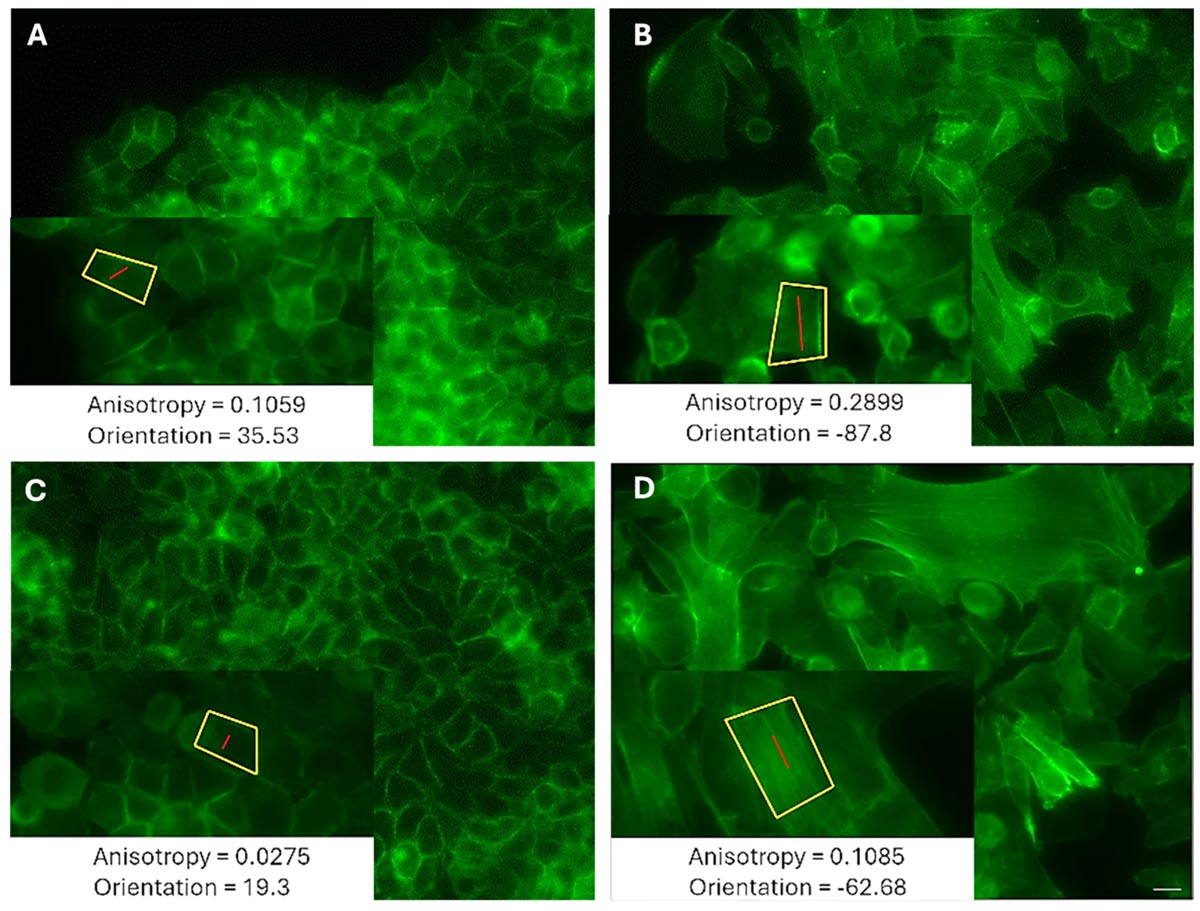
Рисунок. Типичное изображение актиновых волокон, окрашенных фаллоидином, клеток LM (A, C) MCF7 и HM (B, D) MDA-MB-231 во время появления. (A, B) Лидерные клетки. (C, D) Периферические клетки. Источник: Life
«Наши эксперименты позволили не просто найти новый способ для выделения лидирующих клеток, но и показать, что эти самые опасные клетки обладают уникальной механо-биологической сигнатурой — комбинацией повышенной способности к поглощению наносенсоров и высокоорганизованного цитоскелета. Это делает их идеальной мишенью для таргетной терапии. Если мы сможем доставлять цитотоксичные препараты непосредственно в них с помощью тех же наночастиц, мы получим мощнейший инструмент для подавления метастазов»,— подытожил Сергей Леонов, заместитель заведующего лабораторией персонализированной химио-лучевой терапии МФТИ.
Таким образом, новизна работы заключается в комплексном подходе, который связывает функциональную способность клетки поглощать наночастицы с ее фундаментальным внутренним строением и агрессивным поведением. В отличие от генетических тестов, которые применимы не ко всем типам рака, этот метод основан на универсальных физических и механических свойствах клеток. Он позволяет выявить опасные популяции внутри опухоли, где клетки могут сильно отличаться друг от друга.
Научная статья: Alexandrova, A.; Kontareva, E.; Pustovalova, M.; Leonov, S.; Merkher, Y.; Navigating the Collective: Nanoparticle-Assisted Identification of Leader Cancer Cells During Migration. Life 2025, 15, 127. DOI: https://doi.org/10.3390/life15010127

