Габриеле Салех, научный сотрудник МФТИ, и Артем Оганов, заведующий лабораторией в МФТИ и профессор Сколтеха, выяснили причину стабильности различных соединений, необычных для «школьной» химии.
Перестройка химических взаимодействий ведет к стабильности «новой» структуры соединений. Результаты исследования опубликованы в журнале Physical Chemistry & Chemical Physics.
Оганов и Салех построили простую модель и сформулировали основные принципы стабильности «запрещенных» веществ. Дополнительно, ученые обновили фазовую диаграмму соединений Na и Cl: добавили новое соединение
Na4Cl3 и две новые структуры Na3Cl. Исследования проводились с помощью алгоритма USPEX в сочетании с квантово-механическими расчетами.
«В этой работе мы показали, как можно рационализировать стабильность при высоких давлениях предсказанных ранее структур», — говорят авторы в своей статье.
Ранее Оганов с коллегами экспериментально обнаружили несколько «запрещенных» соединений — Na3Cl, NaCl3, NaCl7 и даже Na3Cl2. Эти соединения устойчивы только при экстремальных давлениях (около 200 тысяч атмосфер) и распадаются в «земных» условиях. Однако понимание того, как эти соединения становятся стабильными при высоких давлениях — задача первостепенной важности для планетологии, междисциплинарной науки об устройстве планет.
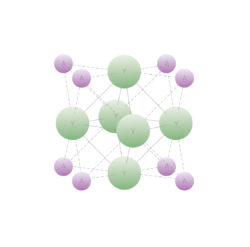
Принцип, объясняющий необычное соотношение атомов Na и Сl в «запрещенных» соединениях, состоит в следующем: количество взаимодействий между атомами Na и Cl увеличиваются, в то время как координационные взаимодействия между атомами натрия разрушаются.
Эти координационные взаимодействия (взаимодействия соседних атомов кристалле ответственны за структуру и свойства кристалла (вспомним углерод и графит).
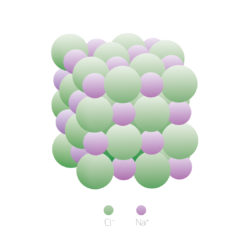
Структура «школьного» NaCl. Изображение: пресс-служба МФТИ.
Структура «запрещенного» A3Y (A=Li, Na, K; Y= F, Cl, Br) (слева). Изображение: пресс-служба МФТИ.
При формировании таких стабильных соединений, новые взаимодействия Na-Cl формируются за счет ослабления металлических связей между атомами натрия. Такая конкуренция между двумя типами связей, на которую влияет давление, и определяет особенности структуры новых соединений.
В дополнение к объяснению стабильности субхлоридов натрия Салех и Оганов предположили, что на месте Na может быть любой щелочной металл, а на месте Сl — любой более тяжелый галоген. В результате, модель позволяет исследовать свойства субгалогенидов щелочных металлов и предсказывать их стабильность.
Формирование субгалогенидов и механизм, ответственный за него, ученые изучали, рассматривая реакцию 2Na +NaCl ->Na3Cl. Или, в более общем случае: 2A + AY —> A3Y(A=Li, Na, K; Y= F, Cl, Br). В ходе такой реакции как раз и образуются дополнительные связи и взаимодействия, и координационное число (количество связей) у галогена растет.
У любого правила должны быть исключения, и вот K3Br и K3Cl имеют совершенно другое строение. Исследователи объясняют это тем, что у калия (K), в отличие от Li и Na, есть энергетически доступные d-орбитали (если заглянуть в таблицу Менделеева, то можно увидеть специальную пометку). При высоком давлении, эти орбитали вступают в игру и образуют иные химические связи, нежели в соединениях лития и натрия.

