
Международная группа ученых, в состав которой входят сотрудники МФТИ, наглядно показала, что яд паука-кругопряда Argiope lobata можно использовать для блокировки активности нейрорецепторов мозга человека. Полученные результаты позволят создать препараты для лечения многих нейродегенеративных заболеваний. Исследование опубликовано в журнале Neuron.
Быстрая передача сигнала между нейронами нашего мозга в подавляющем большинстве случаев происходит за счет выброса передающим нейроном специального сигнального соединения — нейромедиатора, который воздействует на принимающий нейрон. В зависимости от эффекта нейромедиаторы подразделяют на возбуждающие и тормозные. Нейромедиатор глутамат в головном мозге человека активирует нейроны за счет присоединения к специальным белкам, встроенным в мембрану — глутаматным рецепторам — и открытия в них ионного канала, пропускающего положительно заряженные ионы. Открытие каналов глутаматных рецепторов приводит к деполяризации мембраны и возникновению потенциала действия, который затем распространяется по отросткам нейрона. При заболеваниях нервной системы происходит излишняя активация глутаматных рецепторов, в особенности тех, которые хорошо проводят кальций. Попадание в принимающие нейроны слишком большого количества кальция запускает процессы апоптоза и приводит к гибели нервных клеток. Поэтому стоит задача разработки специальных блокаторов для регулирования этого процесса.
Исследователям удалось изучить молекулярную структуру комплекса глутаматного рецептора с тремя блокаторами, включая природный токсин аргиопин из яда паука-кругопряда Argiope lobata и два искусственных соединения. Химическая формула всех трех блокаторов состоит из двух частей: «головы», напоминающей остаток ароматической аминокислоты, и «хвоста» различной длины, включающего аминогруппы, соединенные алифатическими углеводородными линкерами. Наблюдения производились с помощью метода криоэлектронной микроскопии, за развитие которого в 2017 году была присуждена Нобелевская премия Жаку Дюбоше, Иоахиму Франку и Ричарду Хендерсону.
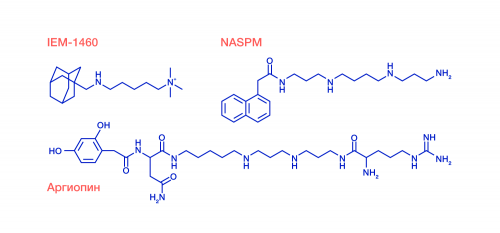
Химические формулы блокаторов глутаматных рецепторов, использованных в работе
«Оказалось, что эти блокаторы проникают внутрь рецептора, когда тот открывается при действии глутамата, при этом они помещают свой положительно заряженный хвост в узкую отрицательно заряженную часть ионного канала — его селективный фильтр, обусловливающий способность пропускать только катионы. Пройти канал насквозь блокаторам не позволяет их голова, застревающая во внутренней полости рецептора», — объясняет руководитель работы Александр Соболевский, выпускник МФТИ и заведующий лабораторией в Колумбийском университете (Нью-Йорк, США).

Структура комплекса глутаматного рецептора и токсина паука Argiope lobata – ацилполиамина аргиопина. (A) Микрографическая картинка, полученная с помощью криоэлектронной микроскопии, где изображения нескольких молекулярных комплексов обведены для примера зелеными кругами (слева), и примеры усредненных изображений молекулярных комплексов (справа). (B) Структура поры ионного канала рецептора с молекулой аргиопина внутри. Рисунок предоставлен Эдвардом Твуми, бывшим студентом лаборатории А. Соболевского, ныне сотрудником Гарвардского университета.
«Полученная информация может быть использована для создания селективных блокаторов глутаматных рецепторов, пропускающих ионы кальция и являющихся важной фармакологической мишенью в целом ряде заболеваний, включая боковой амиотрофический склероз (болезнь Шарко), эпилепсию, гибель нейронов при ишемии и нейродегенерацию при болезнях Альцгеймера и Паркинсона», — рассказывает Мария Елшанская, выпускник МФТИ и научный сотрудник Колумбийского университета.
«Примечательно, что в работе мы использовали токсин паука, открытый академиком Евгением Гришиным в 1986 году. Получается, что те вещества, которые паук использует для убийства жертвы, мы применяем для исследования основ функционирования нервной системы, и они же помогут в создании новых лекарственных препаратов для лечения нейродегенеративных заболеваний», — добавляет Александр Василевский, преподаватель кафедры физико-химической биологии и биотехнологии МФТИ и заведующий лабораторией в ИБХ им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН.
Здесь важно отметить, что токсины и их синтетические аналоги блокируют селективно те рецепторы, которые хорошо пропускают кальций. Они не влияют на непроницаемые для кальция рецепторы, наиболее важные для проведения нервных импульсов в мозге. Преимущество препаратов, которые будут синтезированы по образу и подобию токсинов, состоит в том, что они будут блокировать только «патологические» рецепторы и не трогать физиологически важные.
Теперь, когда известно как токсины и их синтетические аналоги связываются в канале глутаматного рецептора, химики будут способны спроектировать новые, более эффективные блокаторы. Они будут препятствовать прониканию в принимающие нейроны излишнего кальция во время заболеваний нервной системы. Это спасет нервные клетки от гибели и восстановит нормальное функционирование нервной системы.

