Флуоресцентные белки — важнейший инструмент в современных биологических исследованиях. При этом размер белка — одна из его ключевых характеристик: чем меньше флуоресцентная метка, тем слабее она влияет на поведение изучаемого объекта. Коллектив ученых из ИБХ им М. М. Шемякина и Ю. А. Овчинникова РАН и МФТИ разработал флуороген-активирующий белок nanoFAST размером всего 98 аминокислот, и это наименьший размер среди всех генетически кодируемых флуоресцентных меток. Работа выполнена при поддержке гранта РНФ и опубликована в престижном журнале Chemical Science.
Флуоресценция — способность веществ переизлучать поглощенный свет с увеличением его длины волны. Это свойство ряда молекул является чрезвычайно удобным для визуализации процессов, происходящих в живых системах: можно легко разделить потоки отражаемого и переизлучаемого света и выделить только те объекты, которые способны флуоресцировать. Флуоресцентные метки (молекулы, которые пришиваются к объекту, за которым требуются следить) очень широко используются в биологии для определения их локализации в клетке, для изучения взаимодействий между белками и прочих целей. Наиболее удобными метками являются белки — их можно генетически закодировать и легко пришить к объекту исследования с использованием подходов генной инженерии. Среди флуоресцентных меток можно выделить флуороген-активирующие белки. Такие белки работают в паре с небольшой органической молекулой — флуорогеном. Сами по себе ни белок, ни флуороген не светятся или светятся очень тускло, однако как только они провзаимодействуют между собой, их комплекс становится яркой флуоресцентной меткой.
Одним из наиболее широко известных флуороген-активирующих белков является белок FAST, разработанный во Франции. FAST имеет сравнительно малый размер и способен взаимодействовать с широким спектром флуорогенов. Тем не менее его пространственная структура до последнего времени оставалась неизученной. Поэтому на первом этапе работы стояла задача получить трехмерную структуру FAST в комплексе с одним из флуорогенов — N871b. Эту задачу удалось решить с использованием спектроскопии ядерного магнитного резонанса, определив как пространственную структуру комплекса FAST/N871b, так и структуру FAST в «свободном» состоянии. Оказалось, что флуороген существенным образом стабилизирует FAST. Без него часть белка становится подвижной и теряет свою спиральную структуру. Что интересно, эта часть FAST напрямую не участвует во взаимодействии с флуорогеном. Это навело ученых на мысль, что белок FAST можно укоротить на 30% без потери его функциональности — так появилась концепция белка nanoFAST (рисунок 1).
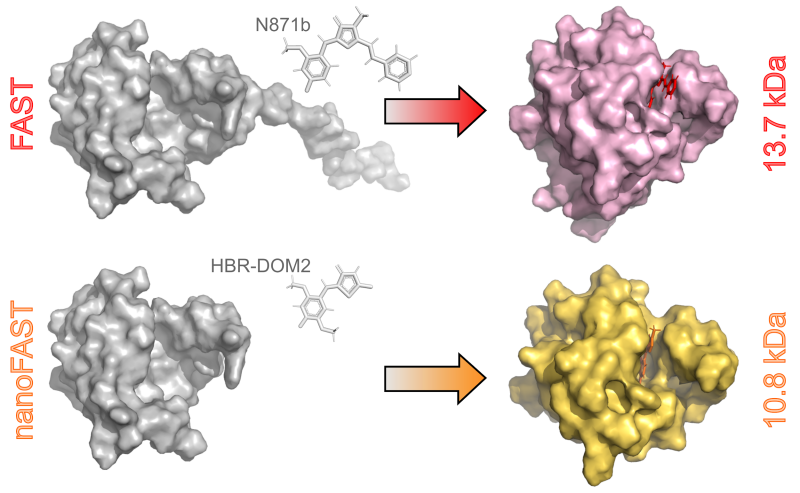
Рисунок 1. Пространственные структуры FAST и nanoFAST в свободном состоянии и в комплексе с флуорогенами N871B и HBR-DOM2. Источник: Chemical Science
Первые эксперименты оказались не особо обнадеживающими: nanoFAST не работал в паре со всеми известными флуорогенами FAST. Чтобы решить эту проблему, сотрудники Института биоорганической химии синтезировали библиотеку потенциальных флуорогенов, состоящую из 40 различных соединений схожей природы. Одно из соединений, HBR-DOM2, оказалось способно взаимодействовать с nanoFAST с образованием флуоресцирующего комплекса, причем яркость флуоресценции не уступала комплексам «материнского» белка FAST с известными флуорогенами. Авторам удалось продемонстрировать, что пару nanoFAST/HBR-DOM2 можно использовать для исследования живых объектов: были проведены эксперименты по флуоресцентному окрашиванию живых человеческих клеток HeLa c визуализацией нескольких клеточных белков (рисунок 2).
Таким образом была создана самая маленькая генетически кодируемая флуоресцентная метка — nanoFAST.
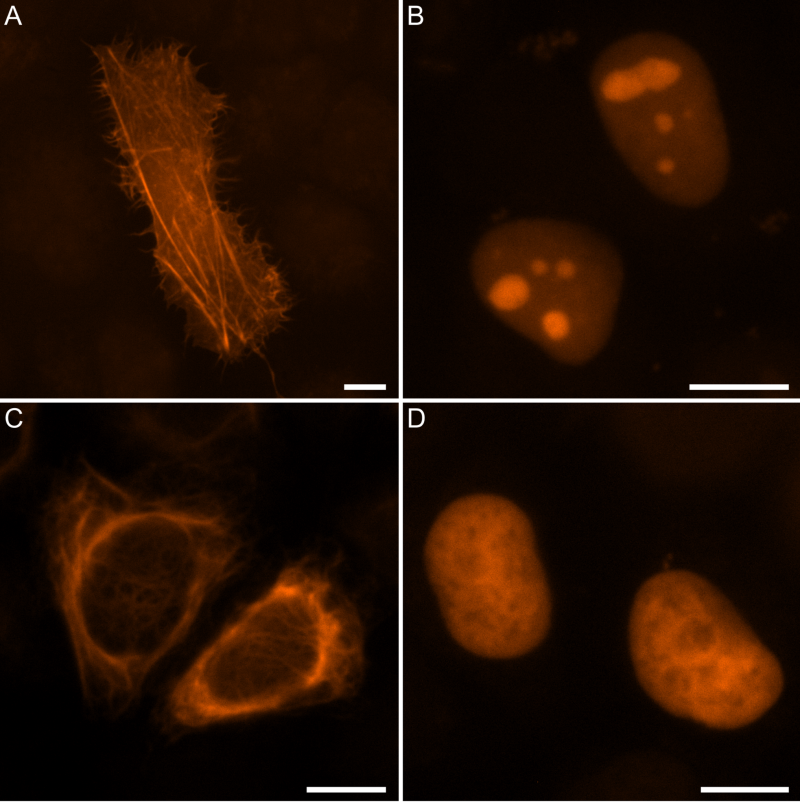
Рисунок 2. Микрофотографии клеток HeLa, окрашенных nanoFAST/HBR-DOM2. Источник: Chemical Science
Работа проведена сотрудниками группы химии гетероциклических соединений, лаборатории биомолекулярной ЯМР-спектроскопии, группы молекулярных меток для оптической наноскопии Института биоорганической химии и Центра исследований молекулярных механизмов старения и возрастных заболеваний МФТИ.
3

