В области асимметрического катализа не хватает теоретических обоснований: часто непонятно, какой катализатор сработает, а какой нет, и почему. А о рациональном дизайне катализаторов речи вообще не идет. Недавно химики из ИНЭОС РАН, ВШЭ и Физтеха опубликовали статью о синтезе хирального катализатора на основе рутениевого комплекса. Один из авторов исследования, Михаил Бойм, рассказывает о том, каково это — разрабатывать хиральные катализаторы вслепую.
Наведение хиральности
Если зеркальное отражение некоторой молекулы не совпадает с ее исходным изображением, то такую молекулу (или шире — любой объект) называют хиральной, а «отражения» — энантиомерами. Обычно их обозначают буквами R и S перед названием молекулы. Разница между энантиомерами может быть очень велика: один может быть лекарством, а другой — ядом. Например, (S)-пеницилламин используют для лечения болезни Вильсона, а его (R)-изомер нейротоксичен. Так что неплохо было бы уметь получать из хиральных молекул строго нужные нам энантиомеры, исключив возможность получения их «злых близнецов». Это и есть задача асимметрического катализа.
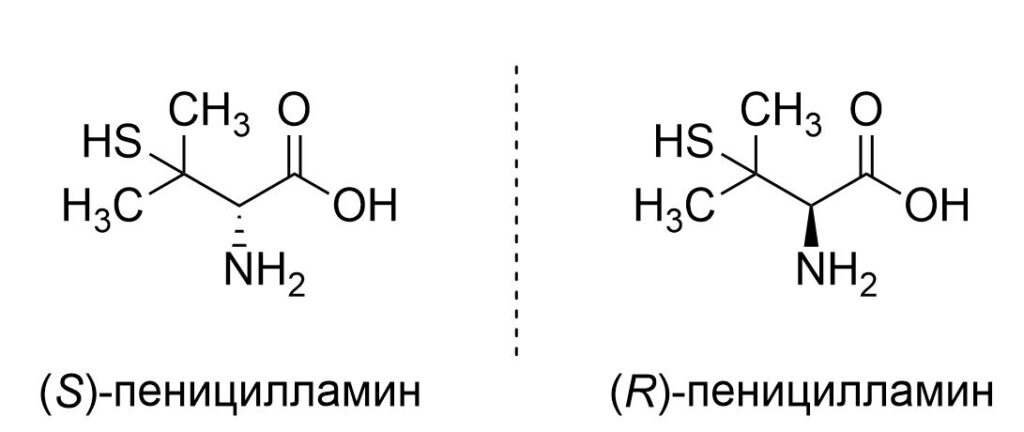
Два энантиомера пеницилламина
Сейчас мы используем для этого катализаторы с атомом металла и хиральным лигандом — органической молекулой, ковалентно связанной с металлом. При взаимодействии исходных веществ с таким катализатором происходит так называемое наведение хиральности: хиральный лиганд заставляет координированные к комплексу реагенты повернуться наиболее энергетически выгодным образом, и на выходе получается один энантиомер продукта. Или не получается. Как повезет. Если влияние лиганда на реагенты слабое, то им без разницы, какой стороной друг к другу подходить, и в этом случае образуется рацемат — смесь, в которой энантиомеров поровну. Если хоть небольшое влияние есть, какого-то из энантиомеров будет больше. Наша задача— найти такую комбинацию из металла и лиганда, чтобы реакция с ними давала на выходе один энантиомер.
В статьях соотношение энантиомеров характеризуют через энантиомерный избыток, разность между их мольными долями, выраженную в процентах. Например, если соотношение в смеси 30 процентов одного энантиомера к 70 процентам другого, то энантиомерный избыток будет равен 40 процентам.
Искать хороший хиральный лиганд все еще приходится банальным перебором. Некоторые проверенные временем лиганды, которые часто используют, можно купить в магазине реактивов. Но они могут не сработать, и тогда приходится разрабатывать новые. Каждый раз, когда ты проводишь энантиоселективную реакцию, то отправляешь продукт на аналитический хроматограф. На выходе получаешь хроматограмму, в которой каждому энантиомеру соответствует некоторый пик. По площадям пиков ты понимаешь, какое получил соотношение энантиомеров.
Все мы, конечно, грезим 99 процентами. Если получишь процентов 90 или больше, а реакция новая и полезная — есть шанс, что катализатор назовут в твою честь. Если 80 — то все неплохо, но вопросы есть. 70 — уже слабовато. В общем, с каждым процентом твои шансы на то, чтобы получить именное место на парковке химиков-синтетиков, да и просто опубликовать статью в хорошем журнале — увядают.
Хиральные арены
Я занимаюсь хиральными ареновыми комплексами рутения уже четвертый год. Мы в этом смысле — пионеры, прежде никто ни в каких энантиоселективных реакциях их не применял. Точнее никто никогда не применял хиральный ареновый лиганд, приделанный к рутению, для наведения хиральности. Мой научный руководитель придумал структуру лиганда на основе природной камфоры — это была отличная идея, потому что исходное вещество дешевое и доступное. Лиганд мы синтезировали и получили его рутениевый комплекс.
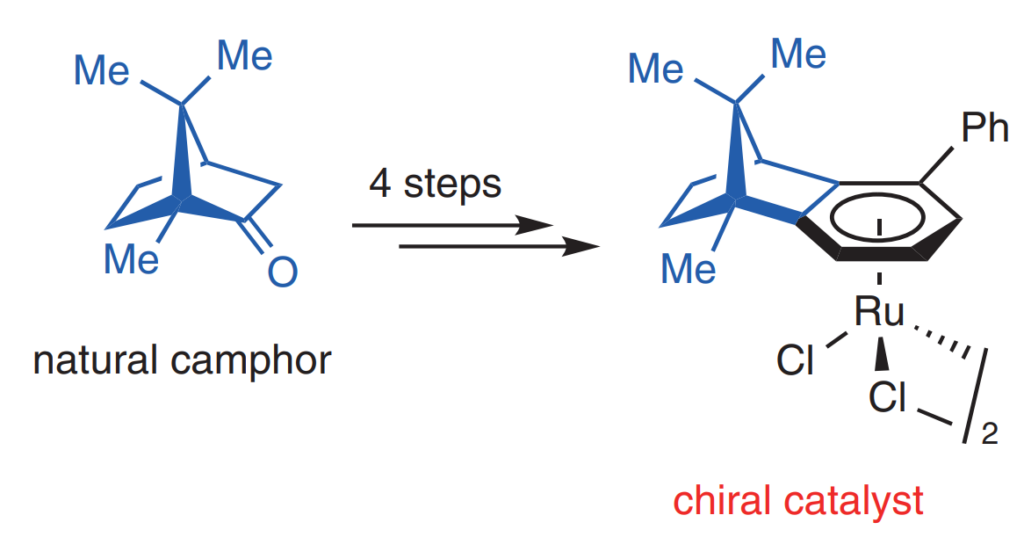
Структура камфоры и полученного рутениевого комплекса. Изображение: R. Pototsky et al. / Synthesis, 2021
Мы знали, что рутениевые комплексы могут катализировать реакции активации связи углерод-водород, в которых на одной из стадий каталитического цикла катализатор рвет связь углерод-водород, а потом присоединяет к углероду какой-то органический кусок. Открыли эти реакции не так давно, но уже выяснилось, что они позволяют в одну стадию получать разные гетероциклы, которые раньше варили длинным путем. А гетероциклы эти часто оказываются биологически активными веществами, поэтому C-H активация стала очень модной темой. На ареновых комплексах рутения энантиоселективно эти реакции никто не проводил, и мы решили попробовать.
Запустили мы несколько активаций с полученным рутениевым комплексом — и ни одна не сработала. Мы предположили, что дело было в том, что связь между нашим лигандом и металлом была слишком слабой, и расчеты это подтвердили. Тем не менее, статью про наш комплекс к печати приняли. А одновременно с этим в журнале Angewandte Chemie вышла статья китайского профессора Ван Цзюня (Wang Jun) о том, как можно получить хиральный ареновый комплекс рутения и применить его в энантиоселективной C-H активации.
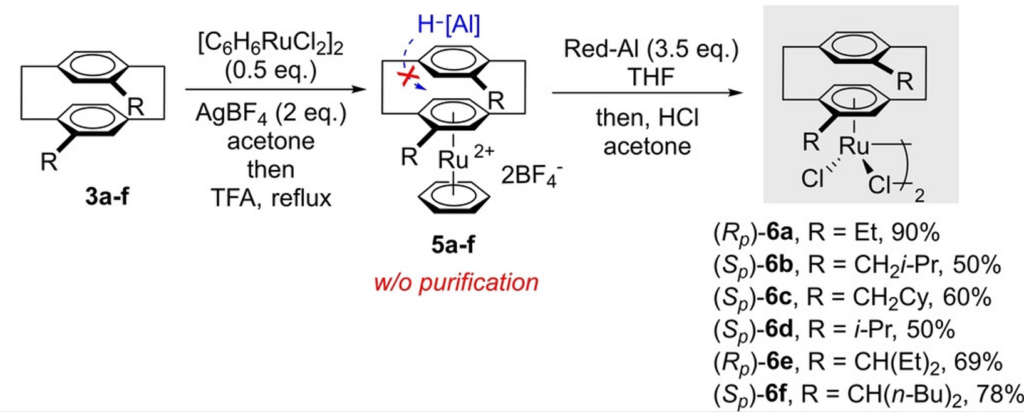
Синтез хирального рутениевого комплекса с производным парациклофана. Изображение: Hao Liang et al. / Angewandte Chemie International Edition, 2022
Ван Цзюнь добился того, к чему стремились мы, но варварскими методами. Катализатор, который сделали китайские ученые, был, на наш взгляд, слишком сложным в синтезе. Химики получали его из не самого доступного производного парациклофана в 10 препаративных стадий (это против четырех у нас). Впрочем, сама статья отлично вписывалась в общую рамку успешных статей об асимметрическом катализе — энантиомерные избытки продуктов были выше 90 процентов.
После неудачи с камфорой мы придумали другой лиганд, который можно сварить в одну стадию из простых реактивов — тетралина и трет-бутилхлорида. И получили его комплекс с рутением — все это заняло около недели. Но лиганд мы выбрали ахиральный. Идея была в том, чтобы приделать его к рутению, получить хиральный комплекс в виде рацемата , а потом поделить сам комплекс на отдельные энантиомеры.
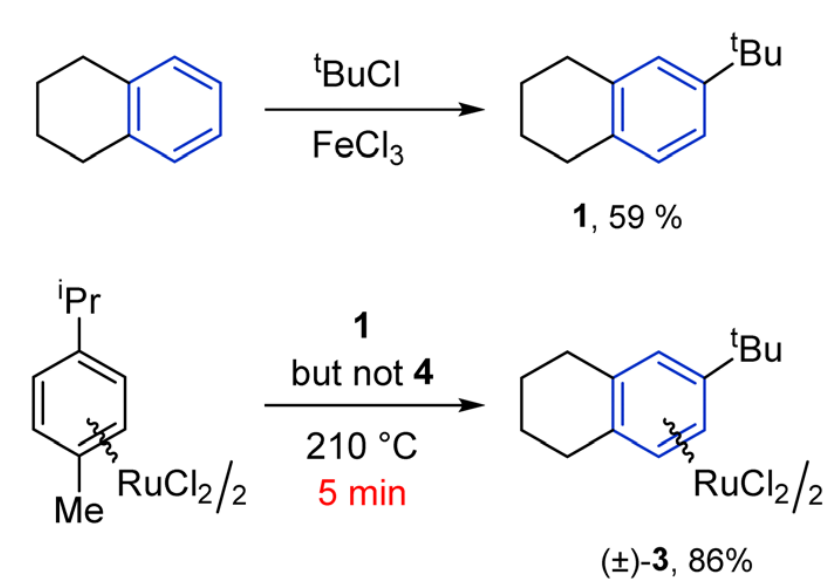
Синтез аренового лиганда из тетралина и получение его рутениевого комплекса. Изображение: M. Boym et al. / Chemical Communications, 2024
Разработка процесса разделения заняла еще несколько месяцев, и в итоге у нас в руках оказался оранжевый порошок готового хирального катализатора. Он неплохо катализировал реакцию С-H активации производных гидроксамовых кислот, в которой образуются хиральные тетрагидроизохинолоны. Но проблема была в цифрах. Вот первые четыре цифры из нашей таблицы энантиомерных избытков: 0, 9, 0, 9. Пятая порадовала — 25. Шестая — 26. Седьмая — 20. Боль.
Где избытки, Лебовски?
Если открыть статью из области асимметрического катализа в каком-нибудь хорошем журнале, значения энантиомерных избытков в ней будут больше 80 процентов. Менее эффективные катализаторы до печати добираются редко. Ну, или появляются в журналах, которые читать молодым и амбициозным ученым не очень хочется. И тут создается впечатление, что пока ты корпишь над желаемым процентом энантиомерного избытка, меняя условия реакции, рациональный дизайн катализаторов уже давно изобрели, и все им поголовно пользуются и не скупятся на похвалы его создателю. А если что-то не получается, берут квантовую химию, искусственный интеллект, магическую добавку и добиваются своего. В общем, все знают, как сделать правильный катализатор, а ты сидишь тут и страдаешь над своими паршивыми 25 процентами.
На самом деле проблема не в знаниях. База вот какая: чем хиральный катализатор занимает больше пространства рядом с координированным субстратом, то есть, чем он тупо физически больше, и чем жестче его структура, тем лучше он даст энантиомерный избыток. Звучит не очень изящно, но других хороших правил в подборе хирального лиганда для еще не проверенной на энантиоселективность реакции нет. Исключений из этого правила много, но альтернативных ему принципов просто нет — и в этом проблема асимметрического катализа. То есть правило есть, оно плохое, других правил мы пока не открыли. Такая пока наука.
Конечно, для каждой отдельной реакции, если она хорошо исследована, есть соображения о том, какой хиральный катализатор может выстрелить. Например, реакции каталитического гидрирования исследованы очень подробно. И механизм хорошо известен, и работающих лигандов много. Придумать еще один работающий не проблема, потому что ты знаешь, как примерно должна выглядеть структура лиганда, и в каких местах есть смысл ее модифицировать. Кроме того, существует набор хиральных органических фрагментов, которые используют особенно часто, и работают они стабильно неплохо, хоть и не всегда.
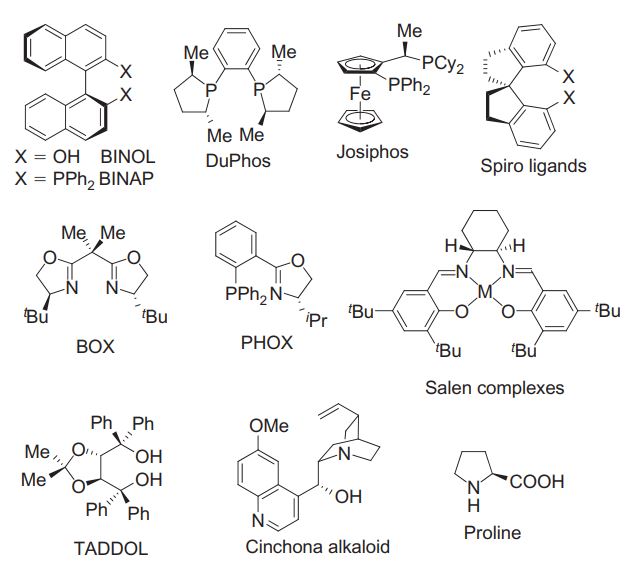
Некоторые популярные структуры хиральных катализаторов и лигандов. Изображение: Privileged Chiral Ligands and Catalysts / Wiley, 2011
О конкретно нашем случае научное сообщество опубликовало ровно две статьи: нашу и еще одну. Так что мы пошли играть в лотерею, занялись научным тыком. Сварили еще один катализатор — он оказался хуже предыдущего. Попробовали еще несколько реакций. Покрутили условия эксперимента. В итоге, пожертвовав выходами и широким кругом субстратов, добрались до 60–80 процентов, отправили рукопись в журнал.
Один из рецензентов высказал к нашей работе такую претензию: проблема, мол, даже не в низких значениях энантиомерного избытка, а в том, что мы никак не объяснили эту самую низкую энантиоселективность. Нет в тексте описания экспериментов и расчетов, которые бы могли подвести под итоговый результат какое-то рациональное объяснение. И был совершенно прав — но у нас хороших рациональных объяснений, которых можно было бы подтвердить или опровергнуть экспериментом, действительно не было! То есть расчет мы, конечно, в ответ ему предъявили, рецензент удовлетворился, статья вышла.
Но вопросы-то остались.
Почему так больно
Почему наша реакция идет только в присутствии фторированных спиртов? Почему, если разбавлять ее обычным спиртом, энантиоселективность повышается? Как влияет структура лиганда на выход и энантиоселективность реакции? На каждый из этих вопросов у нас есть гипотетический ответ, но верифицировать их экспериментально очень сложно.
Во-первых, потому что механизм нашей реакции достоверно не известен. Открыли ее в 2021 году, а исследовать все особенности механизма — задача на годы или десятки лет. Обычно этим занимаются несколько научных групп, у каждой из которых свой фокус. Кто-то делает высокоуровневые расчеты, кто-то выделяет интермедиаты, кто-то собирает все это вместе. Но далеко не у каждой реакции достаточно поклонников, чтобы хватило для подробного исследования. И, во-вторых, потому что ареновые лиганды в рутениевых комплексах очень подвижные: ареновое кольцо крутится над рутением и может повернуться как угодно. И для того чтобы провести качественные расчеты, нужно учитывать каждый способ поворота лиганда, а это занимает много времени и сил.
Интерес к тому, как вообще происходит наведение хиральности, возник вместе с первыми работами по каталитическому гидрированию в 60-х годах XX века. Тогда ученые нашли первые эффективные катализаторы на основе фосфиновых комплексов родия и научились получать продукты с энантиомерными избытками около 80 процентов. В 70-х годах стало ясно, что в гидрировании лучше других работают фосфиновые лиганды с осью симметрии C2, и появились первые объяснения этому явлению, первые гипотезы о процессе наведения хиральности. А еще появились первые промышленные применения асимметрического катализа — синтез хиральных ментола и лекарства от болезни Паркинсона леводопы.
В 2001 году за прорывные работы в области асимметрического катализа Рёдзи Ноёри, Уильям Ноулз и Барри Шарплесс получили Нобелевскую премию по химии. В своей нобелевской лекции Ноулз рассуждает о механизме наведения хиральности в каталитическом гидрировании и предлагает модель для определения оптической конфигурации продукта. В той же лекции он говорит о том, что хоть предложенная модель и неплохо работает, с новыми экспериментальными данными она не согласуется. В общем, проблемы с теоретическими обоснованиями начались сразу.
Тогда выяснить детали механизма было очень сложно, в том числе потому что квантово-химические расчеты занимали много времени. Сейчас, благодаря развитию теории функционала плотности и увеличению мощности компьютеров, дела обстоят лучше. И механизм наведения хиральности в родий-катализируемом гидрировании подробно изучен.
Тем не менее, чтобы выяснить, как происходит наведение хиральности в одной реакции, приходится сначала выяснять по каким путям она вообще может идти, потом находить стадии каталитического цикла, на которых происходит наведение хиральности, потом рассчитывать, как на этих стадиях структура лиганда влияет на наведение. Кроме того, если в реакции используется растворитель, способный сольватировать реагенты и катализатор, его тоже нужно учитывать в расчетах. А моделей сольватации, которые работают надежно, пока просто нет. В итоге получается, что разобраться с наведением хиральности в одной реакции — это огромный сборник задач для нескольких научных групп.
Вообще хорошие данные о механизмах наведения хиральности есть, если говорить щедро, где-то для десятка наиболее изученных реакций. Все остальное — темный лес. Никакой общей теории нет, потому что у каждой реакции так много особенностей, что непонятно, с какого конца за эту теорию браться. И можно ли вообще ее разработать. То есть понятно, что в какой-то момент хиральный лиганд заставляет одно из исходных веществ повернуться определенным образом. Но в какой момент и какой лиганд нужно взять, чтобы это происходило эффективнее, заранее никогда непонятно. И пока химики не накопят больше данных о хорошо идущих энантиоселективных реакциях, а суперкомпьютеры для квантово-химических расчетов не станут доступны каждому, асимметрический катализ так и будет ехать на удаче и количестве свободных рук.
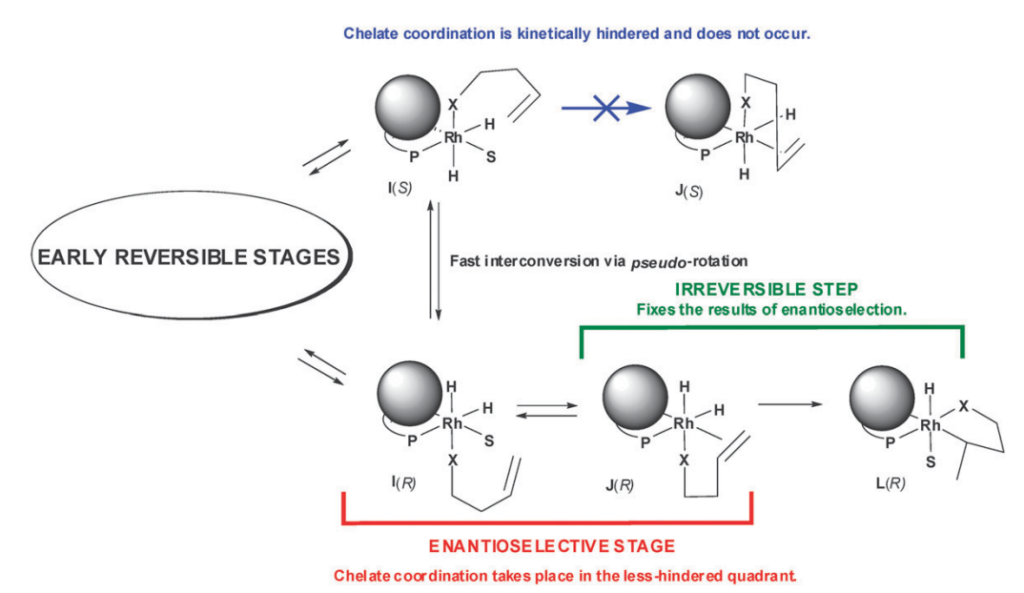
Механизм наведения хиральности в реакции гидрирования алкенов на фосфиновых комплексах родия. Сначала алкен координируется с наиболее выгодной стороны комплекса, а стереохимический результат фиксируется на необратимой стадии внедрения родия в двойную связь углерод-углерод. Изображение: Enantioselection in Asymmetric Catalysis / Taylor & Francis, 2017
Разрабатывать энантиоселективные реакции вопреки сложностям нужно. Во-первых, чтобы копить эти самые данные, на которых кто-то однажды сможет разобраться в наведении хиральности. Во-вторых, чтобы получать оптически чистые препараты для медицинской химии. Порядок этих причин можно менять — это уже зависит от того, что вам, как ученому, ближе, прикладная или фундаментальная ценность науки. Кроме того, реакции с энантиомерным избытком, приближающимся к 100 процентам, особенно ценны. Если избыток такой высокий, значит, скорее всего, реакция идет по одному определенному пути, и изучать наведение хиральности становится проще, потому что все остальные сценарии при расчетах можно отбросить.
А значит, шанс назвать катализатор своим именем у меня все еще есть. Как и у множества моих коллег. Хотя — и тут, конечно, включаются сугубо мои ценности — лучше бы, конечно, нам теорию.

