
«Улучшенный» белок Sox2 в представлении ChatGPT
Источник: ChatGPT
Пять лет назад Сэм Альтман, создатель OpenAI, вложил 180 миллионов долларов в биотехнологический стартап Retro Biosciences — и это стало одной из крупнейших частных инвестиций в компанию, которая ставит своей целью продление человеческой жизни. Теперь из этой инвестиции выросла коллаборация: исследователи старения объединили усилия с разработчиками языковых моделей, работающих на Альтмана. В итоге, как представители компании сообщили журналу MIT Technology Review, они с помощью OpenAI усовершенствовали белки, которые превращают взрослые клетки человека обратно в зародышевые. Рассказываем, какое отношение это имеет к продлению жизни и какие вопросы возникают к заявленному результату.
Искусство распаковки
Сколько исследователей старения — столько и идей по поводу того, как его можно было бы остановить или хотя бы отодвинуть на попозже. Но IT-гиганты и связанные с ними звездные стартапы в основном делают ставку лишь на одну из них. И Calico — сайд-проект Google, и Altos Labs — детище Джеффа Безоса и Юрия Мильнера, и NewLimit, основная Брайаном Армстронгом, а теперь и Retro Biosciences, — все они занимаются репрограммированием.
Этой технологии чуть меньше двадцати лет. В 2006 году японские ученые Синъя Яманака и Казутоси Такахаши впервые получили из клеток мышиной кожи аналог зародышевых клеток. Они подобрали четыре белка, которые меняют набор генов, работающих внутри клетки. Эти белки «глушат» гены, отвечающие за специализацию, — например за то, чтобы клетка производила межклеточное вещество и образовывала плотные контакты с соседями, как это делают кожные фибробласты, — и позволяют «заговорить» генам плюрипотентности, то есть тем, которые поддерживают клетку в неспециализированном состоянии.
При этом фактически откатывают назад всю программу развития клетки. Превращаясь из зародышевой в фибробласт, клетка скручивала и упаковывала свою ДНК: ненужные гены (которые могли бы работать, например, в клетке кости или глаза) сворачивала в плотные клубки, с которых невозможно считать информацию, а нужные гены, наоборот, поддерживала развернутыми. Факторы Яманаки запускают распаковку генома и таким образом клетка возвращается в эмбриональное стволовое состояние. Результат назвали индуцированной плюрипотентной клеткой, или иПСК (биологи специально не называют их эмбриональными стволовыми, потому что не уверены, что клетки приобретают все без исключения свойства зародышевых).
Яманака и Такахаши перепробовали множество белков в разных сочетаниях, но в итоге оказалось, что для полной распаковки ДНК достаточно всего четырех: Oct4, Klf4, Sox2 и c-Myc. Их потом назвали факторами Яманаки.
Структура KLF4
Метод репрограммирования стал настолько популярен, что Нобелевскую премию за него вручили уже через шесть лет, в 2012-м (что для премий по физиологии и медицине невероятно быстро). Лаборатории по всему миру обрели неограниченный источник стволовых клеток — чтобы их добыть, не нужно было больше получать и разрушать зародыши. А из иПСК уже можно было выращивать любые другие клеточные типы.
А через несколько лет этот метод взяли себе на вооружение исследователи старения. И подумали: что если не распаковывать ДНК целиком, а остановиться на полпути? Раз клетка по мере старения скручивает свой геном, то, быть может, если его немного раскрутить, она станет немного моложе? Главное — не превратить ее обратно в зародышевую, а просто вернуть немного назад, сделать чуть ближе к стволовой. Теоретически этого можно добиться, если не дать факторам Яманаки действовать постоянно и оборвать процесс распаковки через несколько дней. В 2016 году такое частичное репрограммирование применили к ускоренно стареющим мышам (у них возрастные болезни появляются раньше обычного, и продолжительность жизни меньше), и они действительно прожили дольше, чем без него.
Также стало ясно, что на людей перенести эту практику будет непросто.
Невыполнимый план
Чтобы распаковка удалась, Яманака и Такахаши вводили в мышиные клетки дополнительные копии генов, кодирующих факторы Яманаки. Но доставить в клетку четыре гена одновременно — задача нетривиальная. Их можно поместить на одну ДНК-кассету, но тогда получится очень большая конструкция, которую сложно пропихнуть сквозь клеточную мембрану. Или же можно их вводить по отдельности — тогда кассеты будут поменьше, но станет меньше и шанс, что клетка проглотит все четыре посылки.
И даже если все гены одновременно оказались внутри ядра и заработали (что тоже не гарантировано, у клетки есть способы «заткнуть» чужеродную ДНК), и клетка начала производить факторы Яманаки, это еще не значит, что они справятся со своей задачей. Дело в том, что у каждого из этих белков есть и обычные функции. А значит, в клетке есть множество веществ, которые с этими белками должны взаимодействовать и мешать им работать слишком активно. Например, c-Myc участвует в делении клетки и, если будет заниматься этим слишком усердно, может превратить ее в опухолевую. Поэтому в клетке есть белки, которые блокируют работу c-Myc. Естественно, они будут препятствовать работе факторов Яманаки и мешать клетке стать стволовой.
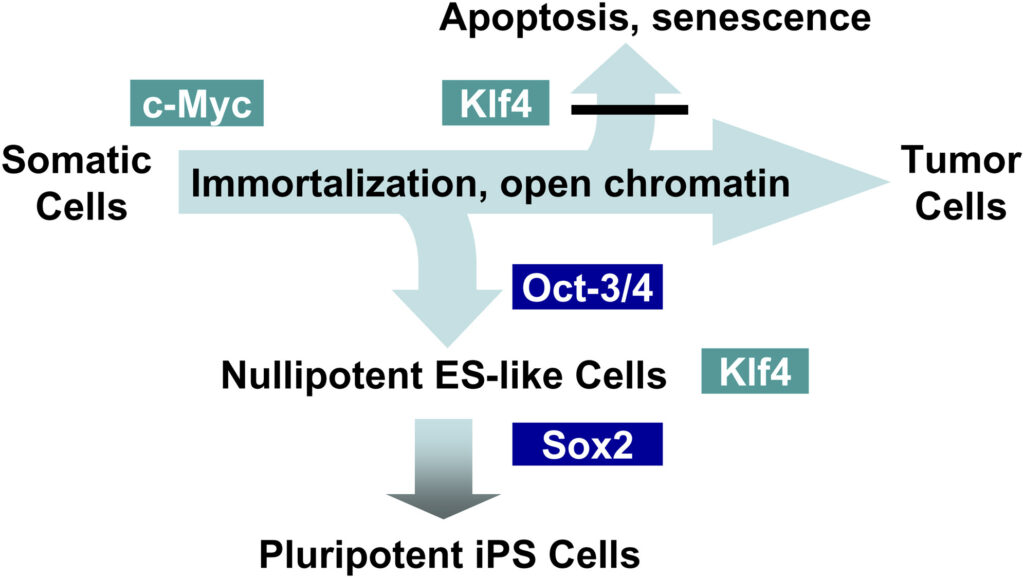
Функции факторов Яманаки
Изображение: Shinya Yamanaka / Cell, 2007
Отсюда возникает первая проблема с репрограммированием — низкая эффективность. Если следовать классическим протоколам Яманаки и Такахаши, то в иПСК превращаются меньше процента из всех клеток. С частичным репрограммированием, казалось бы, должно быть проще — там срок работы факторов Яманаки меньше, и значит, даже полезно, если внутриклеточные белки будут их быстро блокировать или уничтожать. Но проблема с доставкой четырех генов в клетку никуда не девается — так что даже в культуре удается репрограммировать не больше четверти клеток.
На уровне целого организма проблем становится только больше. Даже один ген сложно ввести в кровоток так, чтобы он достался поровну клеткам в разных органах и тканях. А с четырьмя задача выглядит и вовсе нерешаемой. Поэтому в эксперименте с ускоренно стареющими мышами ученые просто встроили в мышиный геном дополнительные гены факторов Яманаки — и клетки начинали производить эти белки по внешнему сигналу (и по нему же потом переставали это делать). Но взять просто так, науки ради, и отредактировать геном человека — нельзя. Поэтому, как заставить клетки наших тел репрограммироваться равномерно, никто пока не придумал.
Держитесь крепче
Вот уже почти двадцать лет ученые ищут способ повысить эффективность репрограммирования. Одни полагают, что дело в гетерогенности самих культур: не все клетки подходят для превращения в зародышевые. Какие-то из них лучше поглощают чужеродную ДНК, какие-то хуже, а еще — в зависимости от их происхождения и степени специализированности — они могут быть в разной мере готовы перепаковать свою ДНК.
Другие говорят, что нужно не зацикливаться на факторах Яманаки и искать другие молекулы, которые могли бы усилить их работу или даже их заменить. Это могут быть, например, регуляторные РНК и малые небелковые молекулы, которые влияют на плотность упаковки ДНК или активность клеточных белков. А исследователи из Retro Biosciences пошли другим путем.
В коллаборации с сотрудниками OpenAI они создали модель GPT-4b micro, которая работает по принципу больших языковых моделей. Ее обучили на большом массиве данных о структуре белков из клеток разных видов животных, а также о том, как эти белки взаимодействуют друг с другом. После этого ее попросили рассчитать, как должны быть устроены факторы Яманаки, чтобы репрограммирование проходило эффективнее.
Эту задачу — как и другие задачи по моделированию белков — гораздо проще решать с помощью искусственного интеллекта, чем вручную. Каждый белок — это нить из сотен аминокислот, которые сворачиваются в сложную форму. Чтобы изменить эту форму, нужно перебрать множество вариантов аминокислотных замен и предсказать структуру, в которую свернется измененная цепочка. Все это проще отдать на аутсорс компьютеру. Половину этой задачи уже умеет решать AlphaFold, за который (в том числе) в прошлом году вручили Нобелевскую премию по химии. А GPT-4b micro, судя по всему, выдает по запросу форму белка, который должен лучше взаимодействовать с нужными вам клеточными молекулами.
Новая модель предложила ученым из Retro Biosciences «усовершенствованные» варианты белков Sox2 и Klf4. Исследователи утверждают, что их эффективность в репрограммировании фибробластов выросла в 50 раз по сравнению с обычными факторами Яманаки.
Модель белков SOX2
Изображение: Protein DataBank
Как именно изменились свойства этих белков, исследователи пока не сообщают. Вариантов может быть множество: они могут крепче держаться за ДНК, могут прочнее связываться с белками-помощниками, а могут, наоборот, хуже связываться с белками-блокаторами или быть устойчивее к расщеплению.
Однозначно судить о том, действительно ли это успех и правда ли GPT-4b micro решила проблему, над которой биологи бились без малого двадцать лет, пока рано. Для этого необходимо, чтобы авторы эксперимента опубликовали свои данные и поделились подробностями исследования. А пока они только готовят материалы к публикации — которая, по их словам, рано или поздно последует, — можно представить себе, что этот результат, если он достоверен, будет означать для исследователей старения и какой от него может быть практический выхлоп.
Чем обернется
Поначалу CEO Retro Biosciences Джо Бетт-Лакруа позиционировал свой стартап как фундаментальный, а не прикладной. Например, Алехандро Окампо — автор эксперимента по частичному репрограммированию на ускоренно стареющих мышах и консультант Retro Biosciences, — говорил, что «другие компании стремятся найти немедленно практическое применение [своей технологии], но в их (Retro Biosciences) случае они могут потратить время на исследование науки, которая за этим стоит». Тем не менее, заявленная на сайте Retro Biosciences цель познанием не ограничивается, а звучит так: «продлить жизнь человека на десять лет».
Как именно Retro Biosciences собираются использовать свое изобретение на пути к этой цели, пока не очень ясно. В разговоре с MIT Technology Review представители компании не стали делать никаких прогнозов, а перечень направлений работы, указанный на их сайте, не совпадает с тем, что Бетт-Лакруа озвучил в своем выступлении на 10-й американской Конференции по исследованиям старения и разработке лекарств. Из его слов следует, что стартап разрабатывает три направления, в которых могут пригодиться «усовершенствованные» факторы Яманаки:
- Омоложение Т-лимфоцитов, чтобы они эффективнее справлялись с опухолевыми клетками.
- Омоложение стволовых клеток крови, чтобы получать из них «более молодую» кровь.
- Частичное репрограммирование отдельных органов in vivo.
И если первые два пункта похожи на иммунотерапию и лечение стволовыми клетками, которые сейчас и так много кто разрабатывает, то третий — это что-то новое. На Конференции Бетт-Лакруа упомянул, что у них есть хорошие результаты по репрограммированию печени in vivo у мышей. Но они нигде пока не опубликованы, и их детали неизвестны. На сайте компании указано, что исследователи также занимаются разработкой генной терапии, так что можно представить себе, что именно таким образом они планируют доставлять факторы Яманаки в органы человека.
«В том, что касается подобных инвестиций, это, конечно, боль, — говорит Николай Ильинский, старший научный сотрудник Центра исследований молекулярных механизмов старения и возрастных заболеваний МФТИ. — Зачем вкладываться в отдельные проекты, когда мы до сих пор не знаем основ? А пока нет никакой отрецензированной статьи про факторы Яманаки от Retro Biosciences, все их заявления голословны».
Кроме того, этот же принцип «усовершенствования» белков — если он окажется действительно рабочим — можно применить и к другим технологиям, помимо частичного репрограммирования. Можно использовать его при полном репрограммировании и таким образом пополнить банк индуцированных плюрипотентных стволовых клеток для выращивания новых тканей и органов человека. А можно попробовать таким же образом улучшить полное репрограммирование — технологию, которая позволяет превратить клетку одного типа в клетку другого типа напрямую, без возврата в зародышевое состояние. Например: фибробласт в мышечную клетку сердца, или астроцит — вспомогательную клетку нервной ткани — в нейрон. Это может быть полезным, чтобы выращивать клетки редких типов из собственных клеток пациента, не мучаясь с поиском донора.
Интересно, чем ответят и ответят ли конкуренты Retro Biosciences — Altos Labs, Calico и NewLimit. Все они на старте тоже позиционировали себя как платформы для фундаментальных исследований и стараются воздерживаться от опрометчивых обещаний. Тем не менее, популярность частичного репрограммирования и масштаб финансирования исследований в этой области заставляют заподозрить, что компании все же рассчитывают на практический результат. Calico, благодаря своим связям с Google, могла бы сотрудничать с разработчиками AlphaFold. А на сайте NewLimit уже указано, что компания «использует машинное обучение, чтобы за один эксперимент протестировать тысячи вариантов репрограммирования».
«И Calico, и Altos labs в своё время открывались с большой помпой и на большие деньги, — говорит Иван Гущин, заведующий лабораторией структурного анализа и инжиниринга мембранных систем МФТИ, — но об их успехах до сих пор ничего не видно и не слышно. Могут ли LLM справиться с белками лучше, чем алгоритмы, которые опираются на физические/математические модели? Лично для меня — вопрос открытый. Вполне может быть, что у Retro Biosciences что-то сработало. Точно так же вполне может быть, что оно сработало не благодаря ChatGPT, и что оно сработало бы лучше, если бы они взяли чужие методы. Но тогда это бы не звучало так красиво в пресс-релизе. Пока что предсказатели структур на LLM (условный ESMFold) работают быстрее, но менее качественно, чем предсказатели на структурных нейронках (условный AlphaFold). Могут ли LLM инжинирить белки лучше, чем специализированный софт? Прямо сейчас — вряд ли».
В какую именно сторону дальше двинутся Retro Biosciences и их конкуренты, предсказать пока сложно. Сам Бетт-Лакруа в подкасте Core Memory говорил, что, по его мнению, будущее за частичным репрограммированием, но точно не ближайшее будущее. Гораздо проще, считает он, полностью репрограммировать клетки и вырастить из них новые ткани. Тем не менее, он утверждал, что уже в 2026 году компания рассчитывает запустить клинические испытания частичного репрограммирования. Неизвестно, будут ли они при этом использовать «усовершенствованные» факторы Яманаки. И в любом случае, прежде чем применять частичное репрограммирование у людей, хорошо бы найти ответы еще на два вопроса.
Первый из них — сугубо практический. Чтобы репрограммирование осталось частичным и не привело к росту опухолей, нужно вовремя остановить факторы Яманаки. Но как это сделать? После того, как мы вводим в живой организм дополнительные копии гена, мы теряем над ними контроль — дальше они как-то распределяются по клеткам и в какой-то, неизвестной нам степени, там активны. Если послать за ними вдогонку какой-то белок-ингибитор, то, опять же, нельзя быть уверенным, что он попадет во все клетки и везде сработает вовремя. Остается разве что надеяться на то, что со временем эти копии генов распадутся в клетке сами собой, но что если нет? И эту проблему «усовершенствованные» факторы Яманаки никак не решают. Можно было бы так их изменить, чтобы они быстрее разрушались в клетке, но кажется, такой задачи Retro Biosciences своей модели пока не ставили.
Второй вопрос — наоборот, фундаментальный. До сих пор не вполне понятно, как именно работает репрограммирование и какие процессы при этом происходят внутри клеток. Например, известно, что превратить взрослую клетку в зародышевую можно с помощью разных комбинаций белков — и без каждого из факторов Яманаки в принципе реально обойтись. А значит, ни один из них не критичен для репрограммирования, и нужно изучать не их, а процессы, которые они запускают. В этом достижение GPT-4b тоже как будто не помогает.
Но это пока. Сами по себе «усовершенствованные» факторы Яманаки, возможно, и окажутся полезны для того, чтобы получать репрограммированные клетки быстрее и эффективнее. Но куда более ценным знанием — если исследователи Retro Biosciences до него доберутся — будет то, почему факторы Яманаки с такой последовательностью лучше работают. Когда станет понятно, с кем они взаимодействуют в клетке и какое из этих взаимодействий критично для репрограммирования — то, может быть, откроются новые способы управлять распаковкой генома, с факторами Яманаки или даже без них.

