Специалисты факультета НБИК МФТИ обнаружили, что сочетание в одном геноме двух слабых мутаций генов, каждая из которых не вызывает существенных нарушений развития, может повышать уязвимость организма к ионизирующему облучению. Открытие может помочь как в прогнозировании последствий облучения, так и в понимании фундаментальных закономерностей развития организма. Работа исследователей опубликована в журнале PLoS One с открытым доступом.
Группа в составе Бориса Кузина, Екатерины Никитиной, Романа Черезова, Юлии Воронцовой, Михаила Шлезингера, Ольги Зацепиной, Ольги Смирновой, Григория Ениколопова и Елены Савватеевой-Поповой изучила мух-дрозофил, в геноме которых сочетались слабые мутации двух разных генов. Ученые выяснили, что эти мутации синергично усиливают фенотипическое проявление друг друга: иными словами, в сумме их эффект значительно более выражен, чем по отдельности.
Полученные исследователями мутантные мухи отличаются целым рядом признаков. Эксперименты показали, что небольшие дозы облучения (не более десяти рентген) способны вызывать у таких мух серьезные дефекты конечностей. У мух с нормальным генотипом такие нарушения не способны вызывать дозы даже в сотни раз большие. Кроме того, сочетание двух мутаций усугубило нарушения памяти, ранее обнаруженное у особей только с одной мутацией, а на клеточном уровне ученые обнаружили, что клетки мутантных мушек хуже справляются с так называемыми супероксидными радикалами.
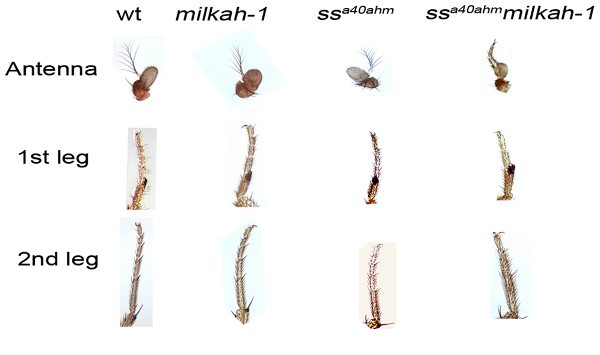
Иллюстрация из статьи ученых: антенны и конечности разных линий дрозофил. Новые мутанты показаны в самой правой колонке.
Супероксидные радикалы — это ионы, которые образуются в клетке как в нормальных, так и патологических условиях. У них очень высокая химическая активность, поэтому избыток супероксидных радикалов приводит к повреждению многих биомолекул, включая ДНК; мутации у подопытных дрозофил снизили способность клетки противостоять этим повреждениям.
Что уже знали
Как пишут ученые, мутации в геноме подопытных мушек затронули два гена: CG5017 и spineless. Оба участвуют в регуляции множества разных функций, причем далеко не все они известны на сегодняшний день. Неизвестно и то, как именно они взаимодействуют между собой. Коллектив из МФТИ, РАН и Лаборатории Колд-Спринг-Харбор поставил перед собой цель уменьшить эту неопределенность. Ученые оттолкнулись от ранее установленных фактов: было известно, что мутации в гене CG5017 нарушают память насекомых, а мутации в гене spineless приводят к целому ряду нарушений при развитии организма. Мутации гена spineles у дрозофил вызывают нарушения развития конечностей, глазных структур и ветвление дендритных отростков нервных клеток.
Белок, кодируемый геном CG5017 относится к семейству нуклеотропных шаперонов. Такие белки являются шаперонами и способны к формированию функциональных комплексов с ДНК и другими белками. При помощи шаперонов формируются элементарные единицы функционирующих хромосом — нуклеосомы. У большинства многоклеточных организмов ДНК в ядрах клеток расположена не в виде смотанной в клубок двойной спирали, а в виде сложного комплекса с белковыми молекулами.
Ген spineless является транскрипционным фактором, то есть геном, задействованным в управлении транскрипцией, синтезом РНК на основе ДНК. Он важен для клетки, так как регулирует транскрипционную активность множества других генов. Кодируемый геном spineless белок регулирует синтез других белков, которые, в свою очередь, выполняют многие важные функции. Если spineless мутирует, то это не влияет на структуру того или иного белка напрямую, однако такие мутации могут либо серьезно ограничить, либо вовсе сделать невозможным синтез сразу многих разных белковых молекул.
Управляемые spineless гены отвечают за правильное развитие животного. Еще в первой половине XX столетия генетики обнаружили, что мутации гена spineless относятся к так называемым гомеозисным мутациям. Это значит, что подобные мутации не прерывают процесс развития, а направляют его по неправильному пути. «Вместо антенных структур возникали ножные и нарушалась их сегментация. Позже выяснилось, что нарушается развитие и глазных структур, и нервных клеток», — пояснил ведущий автор статьи Борис Кузин, сотрудник лаборатории стволовых клеток мозга факультета НБИК и руководитель группы генетических механизмов органогенеза Института биологии развития РАН.
Что нашли?
В новой работе удалось показать: ген spineless связан еще и с формированием долговременной памяти и нейтрализацией различных токсинов. При помощи spineless и регулируемых им белков клетка избавляется как от попавших извне ядов, так и токсинов, образовавшихся после ионизирующего облучения.
Как рассказал Борис Кузин, сочетание в одном геноме слабых мутаций генов spineless и CG5017 приводит к синергическому эффекту и ослаблению функций продуктов гена spineless. Мушки с двумя мутациями не справляются одновременно с детоксикацией и управлением развитием многоклеточного организма.
«По-видимому, следствием нарушения процесса детоксикации является усиление нарушений морфогенеза конечностей в ответ на действие даже малых доз радиации. Судя по всему, функционально-активных продуктов spineless у таких мух недостаточно для совокупного обслуживания процессов развития и детоксикации», — говорит исследователь. Необходимо подчеркнуть, что у многих генов есть функциональные аналоги: поражение одного в результате мутации в какой-то степени компенсируется за счет других. А кроме сильных мутаций, полностью выводящих ген из строя, есть и слабые, приводящие не к полной, а частичной потере функций.
Что это значит?
Открытие, как утверждают ученые в своей статье, может пролить свет на проблему индивидуальной чувствительности к радиации — известно, что малые дозы радиации иногда вызывают серьезные врожденные нарушения, а иногда не оставляют никаких следов. Это отчасти связано с априорно случайным характером воздействия ионизирующего излучения, но кроме этого есть и ряд генетически обусловленных молекулярно-биологических отличий, многие из которых пока не определены.
«Эти результаты, — пишут исследователи в своей статье, — могут иметь практическое приложение не только в случае модельных организмов. Так как эти гены в ходе эволюции не очень сильно изменились, не исключено что можно выделить человеческие мутации, которые повышают уязвимость к радиации даже в малых дозах. Такие малые дозы неизбежны при прохождении медицинских обследований, при авиационных перелетах или при проживании в районах с повышенным естественным фоном». По мнению ученых, удешевление методов прочтения генома приведет к тому, что сопряженные с повышенной чувствительностью к радиации мутации можно будет выявлять и учитывать, например, при назначении диагностических процедур.
Усиление эффекта от мутации CG5017 при мутации spineless и наоборот, усиление эффекта от мутации spineless при нарушении CG5017 подтверждает взаимодействие разных генов. Исследователи предполагают, что кодируемый геном белок CG5017 запускает синтез других белков, необходимых в том числе для правильного функционирования белков, кодируемых теми генами, которые регулирует spineless. Детальное изучение этого взаимодействия позволит ученым выяснить то, как развиваются многоклеточные организмы , как в ходе эволюции у них появилась способность противостоять воздействию различных токсинов и использовать её в ходе освоения новых экологических ниш с помощью механизмов памяти.
Для справки: про исследователей
Ведущий автор исследования — Борис Александрович Кузин, сотрудник лаборатории стволовых клеток мозга факультета НБИК и руководитель группы генетических механизмов органогенеза Института биологии развития. В числе его научных интересов — процессы регуляции транскрипции генов, детерминации и дифференцировки клеток, морфогенеза. Григорий Ениколопов руководит лабораторией стволовых клеток на факультете НБИК МФТИ и входит в число ученых, получивших так называемые «мегагранты» — целевое финансирование в рамках программы Правительства РФ по привлечению в университеты ведущих специалистов.
Для справки: про гены и не только
ДНК хранит информацию за счет того, что ее составные блоки, нуклеотидные пары, соединяются в определенном порядке (нуклеотидная последовательность). На матрице ДНК может синтезироваться другая молекула — РНК. Она отличается химическим составом и тем, что чаще всего представляет одинарную, а не двойную нить. Молекулы РНК либо служат матрицей для синтеза белка (каждым трем нуклеотидам РНК соответствует одна аминокислота в белке), либо сами выполняют ту или иную функцию — например, некоторые РНК являются ферментами, катализаторами биохимических реакций.
ДНК, как подчеркивалось выше, находится в клетке не сама по себе, а в комплексе с белками. Эти белки обеспечивают возможность избирательно «отключать» клетке часть генов, делая невозможным процесс синтеза РНК или, как говорят биологи, транскрипцию. Есть и определенный класс белков, которые, напротив, запускают процесс синтеза РНК, и их называют транскрипционными факторами.
Изучение механизмов управления транскрипцией (на сегодня известно множество способов запустить или остановить транскрипцию) является важнейшей задачей молекулярной биологии. Это обусловлено сразу несколькими причинами:
— во-первых, именно разная транскрипция генов приводит к тому, что одни клетки в ходе развития организма становятся нейронами, а другие, к примеру, клетками печени или кожи. Процесс развития организма немыслим без специализации клеток.
— во-вторых, различия в активности генов могут пролить свет на процесс старения, на превращение обычных клеток в раковые и на развитие множества разных болезней.
— в-третьих, в ходе эволюции многие важные и связанные с появлением нового вида признаки появились не из-за возникновения принципиально нового белка, а за счет изменения схемы развития того или иного органа. Исчезновение хвоста у предков человека, к примеру, явно не требовало новых белков, но зато требовало выключения в определенный момент эмбрионального развития комплекса тех генов, которые связаны с формированием позвонков.
— в-четвертых, «включение» и «выключение» генов в определенной последовательности сопровождает многие необходимые для нормальной жизнедеятельности процессы. В их числе консолидация (закрепление) памяти, переваривание пищи, увеличение мышечной массы при длительных физических нагрузках и многое другое.
Многие гены взаимодействуют друг с другом, причем это взаимодействие может протекать по разным сценариям. Кодируемый одним геном белок может вступать в реакцию с белком, который кодируется вторым геном, и продукт такой реакции, в свою очередь, запустит синтез РНК с третьего и четвертого гена. Или, напротив, подавит синтез еще одного белка. В настоящий момент ученые активно изучают подобные взаимодействия.
Пресс-служба МФТИ выражает признательность Борису Кузину за помощь в подготовке материала.

