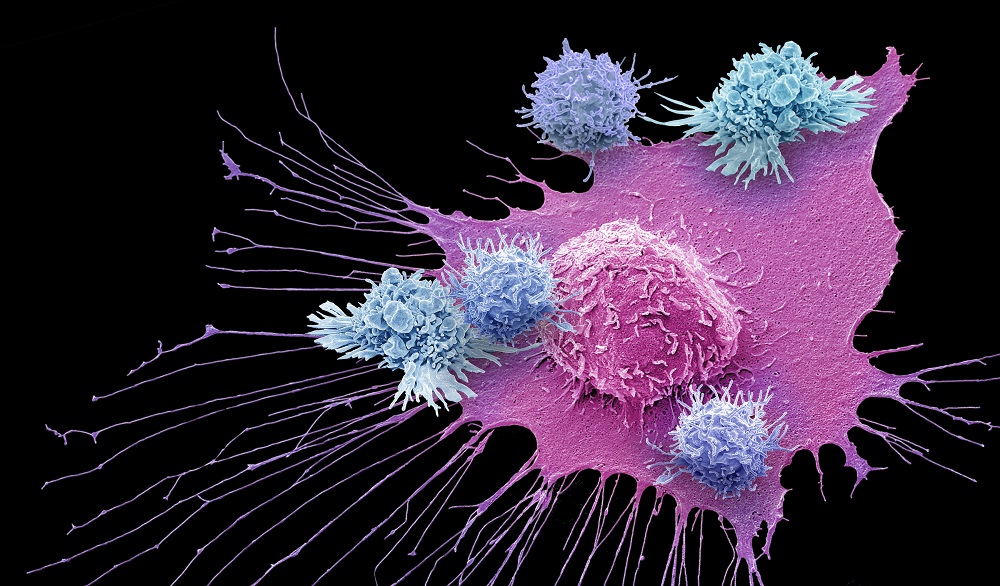
Т-лимфоцит (синим) атакует раковую клетку (розовым). Раскрашенное изображение, полученное на сканирующем электронном микроскопе. Источник: Steve Gschmeissner/Science Source
В науке случаются открытия, которые ознаменовывают конец одной эпохи и начало другой, совершенно новой реальности. 12 апреля 1961 года Юрий Гагарин стал первым человеком в мировой истории, совершившим полет в космос, и в этот день началась новая эра в освоении космического пространства. Другим достижениям нужно много лет, чтобы их значение проявилось: например, так было с механическими часами, которые изобрели еще в XVI веке, а повсеместно их стали носить только в XIX.

Джеймс Эллисон, нобелевский лауреат по медицине 2018 года. Иллюстратор: Niklas Elmehed/Nobel Media

Тасуку Хондзё, нобелевский лауреат по медицине 2018 года. Иллюстратор: Niklas Elmehed/Nobel Media
Стандартное оружие
Доступные на сегодня методы лечения агрессивных видов рака, помимо хирургии, — это радиотерапия, химиотерапия и гормональная терапия. Они убивают раковые клетки, повреждая их ДНК или прерывая другие важные клеточные процессы.
Беда в том, что раковая опухоль состоит из собственных клеток тела, поэтому такие методы лечения, как лучевая и химиотерапия, не избирательны: они атакуют как больные, так и здоровые клетки. Хирургия может быть более селективной, но при некоторых видах рака, например, крови, хирургическое вмешательство невозможно.
Нобелевский лауреат Пол Эрлих (Нобелевская премия присуждена ему совместно с Ильёй Мечниковым за работы в области иммунологии) впервые предположил, что иммунная система может контролировать рак, более 120 лет назад. Действительно, почему бы не приспособить эту хорошо продуманную систему?
Взять, к примеру, наши Т-лимфоциты: у них есть рецепторы для распознавания «своих» и «чужих» клеток. Если бы ученые могли просто немного подкорректировать Т-лимфоциты, чтобы те распознавали раковые клетки как «чужие», у них бы появился готовый метод терапии рака.
Изобретение чекпоинт-терапии
Но все не так просто. Задолго до Нобелевской премии этого года Эллисон и Хондзё по отдельности обнаружили, что существуют «ускорители» и «тормоза» — специфические белки, которые, связываясь с Т-лимфоцитами, могут подавлять или активировать работу иммунной системы. Гармоничный баланс между тормозами и ускорителями позволяет иммунной системе распознавать и уничтожать чужаков, при этом не трогая своих. Стоит отметить, что слишком активный иммунитет становится причиной развития аутоиммунных заболеваний — патологий, при которых клетки иммунной системы начинают работать против собственных клеток организма. Чтобы не допустить этого, существуют тормоза.
В 1990 году Джеймс Эллисон в лаборатории Университета Беркли (Калифорния) изучал рецептор под названием CTLA-4, который тормозит активность Т-лимфоцитов. В то же время фармкомпании разрабатывали препараты для лечения людей с аутоиммунными заболеваниями, основанные на усилении рецептора CTLA-4. И несмотря на то, что результаты были неплохими, Эллисона этот аспект применения CTLA-4 не интересовал. У него была идея использовать для блокировки белка антитело, чтобы освободить Т-лимфоцит из капкана для борьбы с раковыми клетками. Уже в 1994 году Эллисон поставил первый свой эксперимент на лабораторных мышах. Рабочая гипотеза была такова: Т-лимфоциты станут более активными и начнут атаковать раковые клетки.
Результаты были феноменальными! Благодаря антителам к CTLA-4, которые подавили угнетение иммунного ответа, мышей удалось вылечить. Такая противоопухолевая терапия оказалась очень эффективной.
Практически одновременно с Джеймсом Эллисоном, в 1992 году, на другом берегу Тихого океана Тасуку Хондзё в Университете Киото в Японии открыл белок Т-лимфоцитов PD-1, который также действовал в качестве тормоза иммунной системы. Блокировка PD-1 показала аналогичный результат: Т-лимфоциты атаковали опухоль. Более того, оказалось, что блокировка PD-1 подходит для более широкого спектра раковых заболеваний.
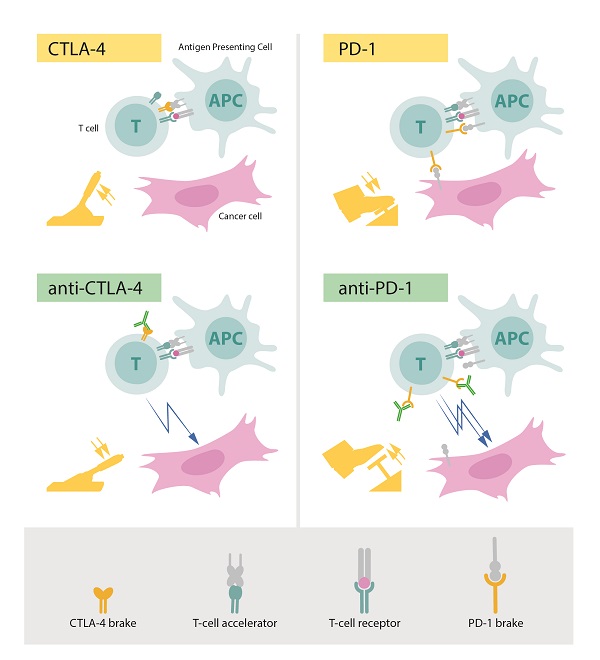
Верхний левый: CTLA-4 выступает тормозом Т-лимфоцитов. Нижний левый: антитела к CTLA-4 (зеленым) блокируют функцию тормоза, что приводит к активации Т-лимфоцитов, которые атакуют раковые клетки. Верхний правый: PD-1 — это еще один T-клеточный тормоз, который ингибирует активацию Т-клеток. Нижний правый: антитела к PD-1 ингибируют функцию тормоза, активизируя Т-лимфоциты и запуская высокоэффективную атаку на раковые клетки. Источник: https://www.nobelprize.org/
Спустя почти 20 лет, в 2010-х, результаты клинических испытаний показали, насколько важна работа Эллисона и Хондзё. Доказано, что терапия PD-1 эффективна против рака легких, почек, кожи, а также лимфомы. Более того, комбинированная терапия блокировки CTLA-4 и PD-1 еще более эффективна у пациентов с меланомой. CTLA-4-блокирующий препарат Ipilimumab, одобренный Управлением по контролю за продуктами питания и лекарствами (FDA) в 2015 году, был первым из нового класса препаратов чекпоинт-терапии.
CTLA-4 и PD-1 — это лишь первые хорошо описанные мишени для чекпоинт-терапии: есть более 10 других, и над ними уже ведутся клинические испытания. К тому же, можно бесконечно комбинировать новые чекпоинты (мишени) с теми, для которых уже доказан положительный клинический ответ у пациентов.
РЕКОМЕНДУЕМ
Книга The Breakthrough: Immunotherapy and the Race to Cure Cancer, автор Charles Graeber.
Сразу после объявления лауреатов Нобелевской премии по медицине и физиологии нам удалось поговорить с профессором молекулярной биологии и химии Научно-исследовательского института им. Скриппс в Ла-Холле (Калифорния) Раймондом Стивенсом (Raymond Stevens), который приехал в МФТИ на конференцию «Биомембраны-2018». Как оказалось, Стивенс работал с Джеймсом Эллисоном в университете Беркли и очень обрадовался решению комитета.
«На мой взгляд, одной из главных проблем современной науки является то, что каждый ученый работает в своей области и редко объединяется с учеными из других областей для совместной работы, — сказал Стивенс. — Эта Нобелевская премия примечательна тем, что иммунология и онкология объединились, чтобы научить иммунную систему бороться с раком. Я надеюсь, что это побудит больше людей думать: «Ого, мы можем работать на стыке разных областей и делать действительно большие открытия!»
Что дальше?

Павел Волчков, руководитель лаборатории геномной инженерии МФТИ
— Эта Нобелевская премия — подтверждение того, что собственные иммунные клетки человека — наиболее перспективное и эффективное средство борьбы с раком. Эта работа вызвала новую волну исследований, которая привела к многочисленным клиническим методам лечения рака. В недавнем выпуске журнала Nature Medicine от июня 2018 года ученые описали клинический случай: у пациентки диагностировали рак молочной железы со множественными метастазами, классическое лечение ей не помогло. Авторы статьи забрали Т-лимфоциты из опухоли пациентки, выделили их, амплифицировали и вернули обратно вместе с блокирующими антителами к PD-1. В результате пациентка полностью излечилась. Без фундаментальной работы Эллисона и Хондзё этого никогда бы не произошло.
В этом году первый российский иммунотерапевтический препарат пролголимаб на основе моноклонального антитела к PD-1 показал хорошие результаты в клинических испытаниях против меланомы. Несмотря на возможный успех лечения, предсказать, поможет ли иммунотерапия конкретному пациенту, почти невозможно. На данный момент уменьшение количества или исчезновение очагов опухоли наблюдается в зависимости от режима приема у 14–44 процентов пациентов. В рамках испытаний препарата один из двух использованных режимов терапии позволил добиться уменьшения или исчезновения опухоли у 44 процентов участников, что является высоким показателем для препаратов подобного класса.
Согласно прогнозам, в ближайшем будущем у трети человечества будет диагностирован рак. И даже несмотря на успехи в области профилактики и раннего выявления рака, значительная часть этих людей будет сталкиваться с уже прогрессирующей болезнью. Хочется верить, что дальнейшие исследования на основе новаторских открытий Эллисона и Хондзё докажут, что собственная иммунная система пациента является наиболее эффективной защитой от рака.


