Открыто 62 новых элемента, выяснен принцип организации Периодической системы, объяснен сам закон, представлено множество его графических интерпретаций. Осталось самую малость: понять, есть ли единственно верное представление «таблицы Менделеева», и на каком элементе она закончится и закончится ли?

Старейшая в мире таблица Менделеева, изготовленная в 1876 году. Источник: пресс-служба СПбГУ
Можно сказать, что к «Международному году Периодической таблицы химических элементов» человечество постаралось окончательно заполнить таблицу — самый тяжелый из известных в настоящее время химических элементов — оганесон с номером 118 — замыкает седьмой ряд таблицы Менделеева, располагаясь в восемнадцатой группе — 18-й. Оганесон появился в таблице в 2016 году, когда ее пополнили четырьмя химическими элементами с номерами 113, 115, 117 и 118 — «нихонием» (Nh), «московием» (Мс), «теннесином» (Ts) и «оганесоном» (Og) соответственно. В наши дни в таблице уже не осталось пустых клеток, и у многих людей, смотрящих на современную Периодическую систему, складывается впечатление, что ученым, наконец, удалось полностью собрать пасьянс из карточек с символами и номерами.
Правда, не исключено, что посмотри в наши дни Дмитрий Иванович на то, что мы называем «таблицей Менделеева», он бы не сразу смог узнать ту таблицу, с которой начинал работать в 1869 году. Во-первых, за 150 лет число известных химических элементов удвоилось — Менделеев вывел свой закон, обладая информацией всего о 56 химических элементах. Во-вторых, за полтора века существования Периодического закона усилия физиков и химиков привели к значительным изменениям самой структуры таблицы. В современной Периодической системе нет элементов ньютония и корония, которые Дмитрий Иванович считал более легкими, чем водород. Также в ней нет включенной в начале ХХ века Менделеевым нулевой группы, зато есть вынесенные из общей таблицы группы близких по свойствам элементов — лантаноидов и актиноидов.
Как графически отображать Периодический закон?
Можно с полной уверенностью сказать, что к своей современной формулировке Периодический закон пришел к 1930-м годам. В результате работ Генри Мозли, Антониуса ван ден Брука, Джеймса Чедвика и Нильса Бора менделеевская формулировка «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса» сменилась на «Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда ядер атомов элементов». Причина периодической повторяемости свойств тоже была обнаружена — периодическое повторение строения внешнего электронного уровня атома.
Периодической системе повезло меньше. Да, конечно, она стала символом, и мы по висящей на стене таблице безошибочно узнаем кабинет химии в любой школе. Проблема в том, что в разных школах, которые могут находиться даже в одном городе, мы сможем увидеть разные версии Периодических систем. О едином видении графического представления Периодического закона до сих пор идут активные дебаты.
Сегодня одновременно существуют короткопериодные и длиннопериодные версии Периодической системы. Есть варианты, в которых водород находится в одной группе с щелочными металлами (причина: у водорода, как и у щелочного металла один электрон на внешнем уровне). Есть таблицы, в которых водород стоит с галогенами (причина — водороду, как и галогену, нужно получить всего лишь один электрон до полного заполнения своего внешнего-валентного слоя). Все эти разночтения объясняются тем, что Периодическая система изначально составлялась Менделеевым с возможностью изменения, а сейчас разные исследователи выбирают тот вариант системы, который больше им по душе. Что же касается высшего арбитра в спорах о законах и определениях в химии — Международного союза теоретической и прикладной химии (IUPAC), — в отношении Периодической системы эта организация ограничивается только рекомендациями, вероятно до сих пор самостоятельно не определившись, как должна выглядеть «единственно правильная» таблица Менделеева.
Нерешительность IUPAC связана с тем, что ученые до сих пор ведут споры об оптимальной конфигурации Периодической системы. Чаще всего эти споры выливаются в противостояние условных «химиков» и не менее условных «физиков». «Химики» считают, что расположение элементов в Периодической системе должно определяться свойствами элемента. По мнению «физиков», химические свойства —это критерий, который сложно измерить количественно (а для искусственно синтезированных трансфермиевых элементов — просто невозможно), и их следует заменить чем-то более фундаментальным, взяв за основу электронную конфигурацию химического элемента. Именно эти противоречия и приводят в конечном итоге к таблицам с разным положением водорода, гелия, элементов третьей группы и ряда других.
Нетрудно заметить, что противоречия сегодняшнего дня о внешнем облике Периодической системы кроются в истории Периодического закона и объяснении его причин с помощью электронных явлений и квантовой механики. Еще до идеи о том, что порядковый номер атома в таблице имеет какой-то смысл, Менделеев окончательное решение о положении элемента принимал, опираясь на химические свойства. Хотя и расставлял элементы по мере увеличения атомного веса.
Открытие протонов и электронов привело к созданию квантовой механики, электронных уровней и подуровней атома. Эти открытия объяснили Периодический закон и попытались внести логику в его графическое отображение. Квантовая механика позволила понять ученым, что свойства химических элементов определяются их электронной конфигурацией, а близость химических свойств — одинаковым строением внешнего электронного слоя. Предложенное в 1936 году немецким ученым Эрвином Маделунгом и уточненное в 1951 году Всеволодом Клечковским правило заполнения электронных уровней и подуровней — орбиталей подробно объясняло принципы организации Периодической системы.
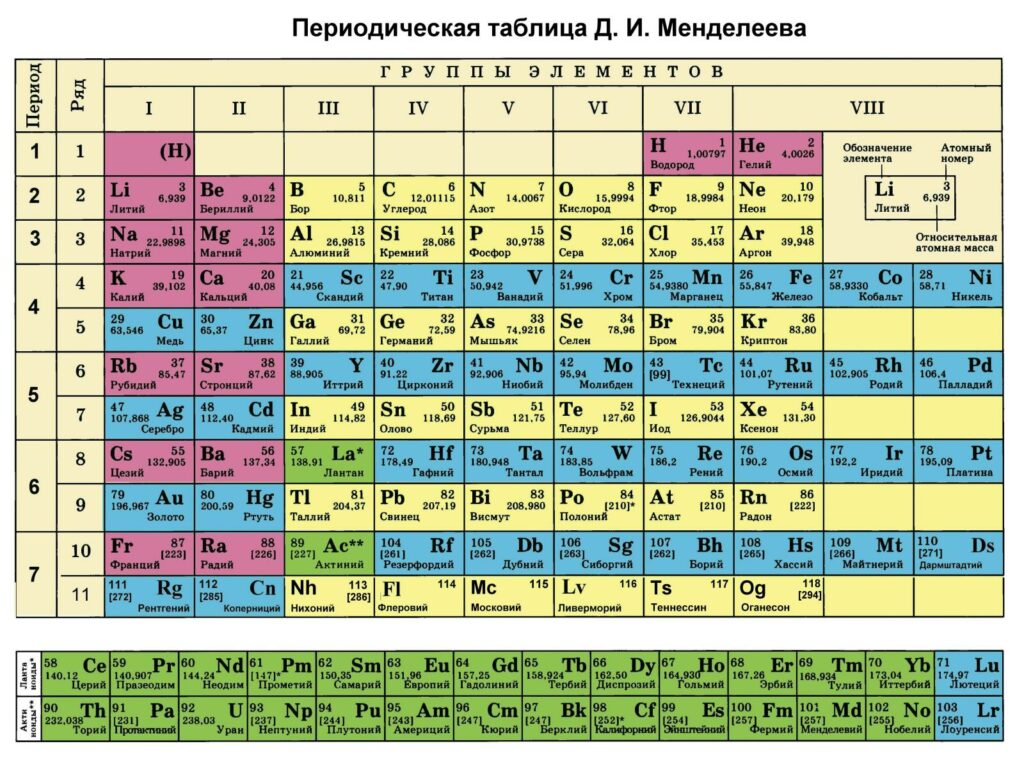
Короткопериодный вариант Периодической системы
К 1940-м годам Периодическая система приобрела тот вид, который привычен для школьных кабинетов химии — короткопериодный вариант с главными и побочными группами, в котором два ряда элементов — лантаноиды и актиноиды — вынесены из таблицы в отдельно расположенные ряды. Первый блок элементов, у которых заполняются f-орбитали, — лантаноиды развернул в отдельный ряд Нильс Бор еще в 1930-е годы. Актиноиды получили «свой» ряд в 1940-е благодаря Глену Сиборгу. Первоначально появление рядов лантаноидов и актиноидов было продиктовано элементарным удобством — если вписать эти элементы в одну линию с другими, таблица удлинится и будет слишком неудобной для чтения — она либо не поместится на обычный лист учебника, либо будет слишком мелкой.
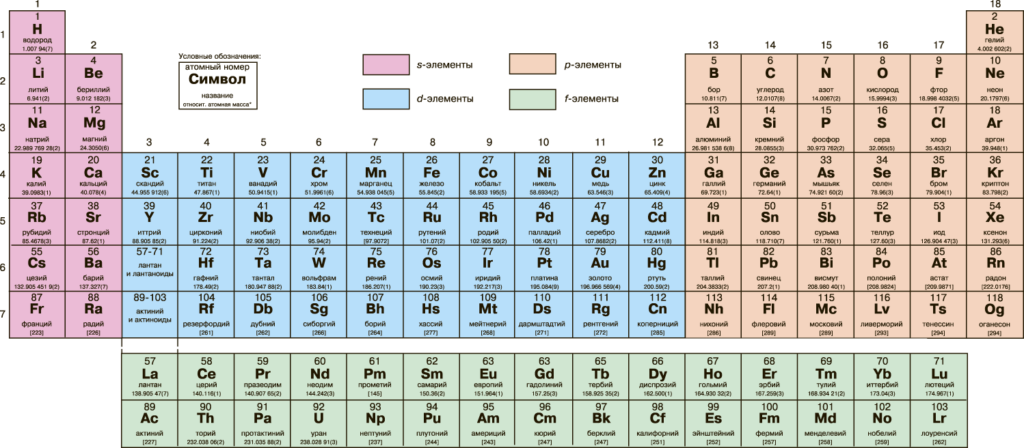
Длиннопериодный вариант Периодической системы (в рекомендации IUPAC от декабря 2016 года)
В настоящее время специальная профильная комиссия IUPAC пытается сконструировать таблицу, которая бы устроила всех, ну или хотя бы набрать достаточное количество аргументов в пользу своего выбора.
Периодическая система химиков
Среди тех исследователей, кто считает, что главное в дизайне Периодической системы — химические свойства, специалист по математической химии Гильермо Рестрепо. Он ссылается на опыт Менделеева и его последователей, которые изучали именно свойства химических элементов. Сам Рестрепо попробовал создать «трехмерную периодическую систему», проанализировав физические и химические свойства 4700 бинарных химических соединений, содержащих 94 химических элемента. Такой подробный математический анализ был сделан для того, чтобы на основании химических реакций понять, какие элементы более похожи друг на друга по свойствам. По результатам анализа была построена карта, в которой элементы, образующие близкие по свойствам соединения, располагались поблизости.
По словам Рестрепо, такое картирование позволяет говорить, что в третьей группе должен стоять лантан — он гораздо больше, чем лютеций, по химическим свойствам похож на бесспорно стоящие в третьей группе скандий и иттрий. Однако этот анализ не позволяет выявить, кто должен занять пока пустующую клетку в третьей группе и седьмом периоде — актиний или лоуренсий.
Таблица для специалистов по квантовой механике
Эрик Скерри из Университета Калифорнии в Лос-Анджелесе придерживается прямо противоположного мнения — считает, что классификация элементов по их свойствам похожа на ранние версии отнесения цветов к одному семейству из-за одинакового цвета их лепестков. Скерри полагает, что для правильной организации Периодической системы необходимо использовать более надежные физические характеристики, к которым он относит электронную конфигурацию. В соответствии с ней, по его мнению, в одной группе со скандием и иттрием должны находиться лютеций и лоуренсий.
Правда, в ряде случаев электронная конфигурация тоже является весьма размытым ориентиром. При организации Периодической системы «физиками» по принципу строения электронной конфигурации тоже были сделаны некоторые исключения. Так, по логике таблицы, у всех d-элементов s-орбитали должны быть заполнены, но медь не подчиняется этой логике и находится на своем месте в Периодической системе благодаря атомному номеру, то есть числу протонов в ядре. Как полагает Скерри, идеальным дизайном Периодической системы было бы простое расположение элементов по их атомному номеру.
Для реализации такого дизайна на практике Скерри советует слегка реформировать таблицу, предложенную в 1920-е годы французским химиком Шарлем Жане. Его вариант предлагает расположить элементы по уменьшению заряда ядра, 18 групп при этом будут заменены на 32 группы. Эрик Скерри считает, что такое расположение элементов не только позволит закрыть вопрос с элементами третьей группы, но и исправит несправедливость по отношению к f-элементам, переместив их из подвешенного под таблицей положения на законное место.
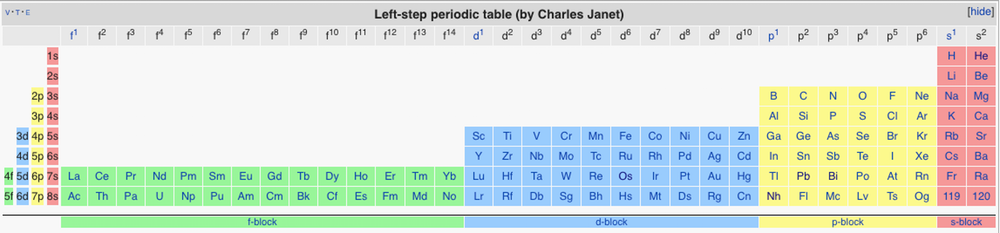
Левоориентированная Периодическая система с 32 группами, предложенная Шарлем Жане в 1920-е годы (с включением известных в настоящее время элементов)
Возможно, такой вариант Периодической системы решит существующие проблемы, но и добавит новых. Мы привыкли видеть гелий в группе, к которой относятся инертные газы, однако в этом варианте он оказывается в группе активных металлов — над бериллием. Хотя Скерри уверяет, что так и должно быть. У гелия, как и у бериллия, магния и щелочноземельных металлов, по два электрона на внешнем уровне, да и существуют эксперименты, доказывающие, что гелий может образовывать стабильные химические связи. Не нужно быть провидцем, чтобы предсказать когнитивный диссонанс, который возникнет у изучающих и преподающих химию, если вдруг когда-то гелий покинет свое семейство инертных газов, переселившись к активным металлам.
Для любителей теории относительности
Релятивистские эффекты, являющиеся следствием теории относительности, — еще один подводный камень, который осложняет попытки создать «Идеальную Периодическую систему». В химических элементах с большими порядковыми номерами электрическое поле ядра разгоняет электроны до скорости, при которой уже нельзя игнорировать релятивистские поправки.
Периодическая система, в которой проводится попытка учесть влияние специальной теории относительности, тоже существует. Ее составил Пекка Пююккё, химик-теоретик из Университета Хельсинки. Он использовал учитывающую релятивистские эффекты модель для предсказания электронного строения и положения в Периодической системе элементов вплоть до номера 172, заглянув намного дальше современных возможностей синтеза сверхтяжелых трансурановых элементов.
Порядковый номер 172, дальше которого Пююккё не пытался заглянуть, неслучаен. Исследования физиков-ядерщиков говорят, что атомные ядра, в которых протоны и нейтроны будут связаны сильными взаимодействиями, могут существовать до элемента, ядро которого будет содержать 172 протона. Системы, содержащие более 172 протонов, просто не смогут быть стабилизированы сильными взаимодействиями, то есть на основании предсказаний можно говорить о том, что у Периодической системы все же есть граница. Естественно, что «расширение границ» методами квантовой химии вызвало споры о корректности не только самой модели расчетов, но и поставленной цели исследования.
Точка в подобного рода спорах может быть поставлена только после того, как соответствующие элементы будут синтезированы, а их электронная конфигурация — изучена, однако Пююккё полагает, что возможности для проверки «надстроенной» им таблицы Менделеева появятся нескоро. Он надеется на то, что до конца XXI века будут получены элементы вплоть до номера 130. Однако не исключена и вероятность того, что физики-ядерщики не смогут синтезировать достаточное количество сверхтяжелых атомов для верификации выкладок Пююккё. В таком случае выкладки финского физика останутся теоретическими моделями и игрой ума, хотя интересными и искусными, но абсолютно бесполезными.

Гипотетическая Периодическая система Пекка Пююккё, в которой смоделированы электронные конфигурации 54 элементов вплоть до номера 172
Появится ли таблица, которая всех устроит?
Кроме более-менее привычных графических форм отображения Периодического закона с 8, 18 и 32 группами, можно найти и куда более экзотические варианты — трехмерные, спиралевидные, круговые и цилиндрические. Глядя на некоторые, кажется, что их авторы старались отойти как можно дальше от таблицы, предложенной Менделеевым, сохранив при этом верность Периодическому закону.

Визуализация периодической системы на обложке журнала LIFE от 16 мая 1949 г.
То, что дискуссия о виде Периодической системы в рамках традиционных ее форм идет до сих пор, более того — то, что до сих пор появляются новые варианты расположения атомов, наводит на мысль, что вряд ли когда-то появится таблица Менделеева, которая останется единственной и будет удовлетворять всех. Даже если IUPAC перейдет от рекомендаций к тому, что назовет правильной только одну из многочисленных вариаций Периодических систем, химики продолжат пользоваться той версией, которая им ближе, объясняя это, например, тем, что не согласны видеть лоуренсий в третьей группе или гелий — в группе с типичными металлами. Осознавая это, комитет IUPAC по работе над формой Периодической системы, членами которого являются и Рестрепо, и Скерри, вероятно, никогда не назовет одну из систем правильной, а все остальные — неправильными.
Конечно, ситуация с одновременным сосуществованием нескольких вариантов «таблицы Менделеева» слегка обескураживает. Однако не нужно забывать, что Периодическая система — просто графическое отображение Периодического закона. Говоря образно — Периодический закон можно сравнить со статуей, существующей в трех измерениях, а различного рода Периодические системы и таблицы — проекции или тени этой трехмерной фигуры, среди которых можно бесспорно выбрать ту, которая нравится больше всего, но невозможно и нелогично говорить о единственной истинной. Химии как науке не чужды компромиссы, и в химических аудиториях сможет найтись место нескольким Периодическим системам — лишь бы они помогали исследователям в работе.
6

