Известно, что живой организм функционирует не по законам физики, хотя в основе его структуры лежат уже известные физике составляющие — атомы. Живые организмы обладают удивительной упорядоченностью, способностью поддерживать себя и самовоспроизводиться. Поэтому для описания их работы требуется открытие новых законов, и в этом направлении развивается современная биология, во многом благодаря взаимодействию с другими областями знаний.

Джеймс Уотсон и Френсис Крик с моделью ДНК в Кавендишской лаборатории в 1953 году
Понятия гена и генетики
Впервые подход к описанию гена как структуры, состоящей из атомов, был предложен в работе Николая Тимофеева-Ресовского, Карла Циммера и Макса Дельбрюка, известной как «Зеленый памфлет» или «Three man paper» — английское название работы «On the nature of gene mutation and gene structure» («О природе генетических мутаций и структуры гена»). Она была опубликована в 1935 году и раскрыла, какую роль в передаче наследственной информации может играть ДНК, открытая в 1869 году физиологом и биологом Фридрихом Мишером. Статьи об открытии спиральной структуры ДНК за авторством Джеймса Уотсона, Фрэнсиса Крика, Мориса Уилкинса, Розалинд Франклин и коллег вышли 25 апреля 1953 года — сейчас эта дата считается Днем ДНК.
Гены — структурные и функциональные единицы наследственности — были определены дополнительно как участки ДНК благодаря исследованиям нуклеиновых кислот Фредерика Гриффита и позднее Освальда Эвери — ранее было принято считать, что наследование признаков происходит через белки-гены. При этом сам механизм наследования был установлен достаточно точно в середине XIX века Грегором Менделем, австрийским монахом и биологом, который представил свою работу в 1865 году: о наследовании признаков, существовании доминантных и рецессивных признаков и гетеро- и гомозиготных организмов. Его труд остался непризнанным и получил возрождение в начале XX века, тогда и появились термины «ген» и далее — «генетика».
Всеволод Макеев, член-корреспондент РАН, заведующий лабораторией системной биологии и вычислительной генетики Института общей генетики РАН имени Н. И. Вавилова, рассказывает: «Генетика — это наука о том, как устроена наследственность: почему дети похожи на родителей, но не очень, почему родные братья и сестры все-таки разные, если они не близнецы. Это очень большая и важная область: как медицинская, так и технологическая. До сих пор генетика, в первую очередь, занималась тем, что изучала, каким образом могут формироваться белки, как они закодированы в геноме и какие изменения в последовательности ДНК приводят к тому, что эти белки перестают выполнять свои функции. Мы — многоклеточные существа, у нас клеток порядка триллиона, а разных типов клеток порядка нескольких сот. И эти клетки отличаются друг от друга по той же самой причине, по которой организмы отличаются от друг друга: в них производятся разные белки. Почему в разных клетках синтезируются разные белки в разное время, на это отвечает наука — функциональная геномика. Если вы изучаете последствия для всего организма, связанные с тем, что в каком-то типе клеток какие-то белки не производятся, получается как раз “регуляторная генетика”. Это жаргонное слово — сейчас такой науки нет официально в рубрикаторе».
Нормальное распределение (на рисунке) в природе встречается достаточно часто: например, характеристики живых организмов в популяции подчиняются этому закону. В «хвостах» распределения лежат самые редкие значения
Мутации и полиморфизмы
Последовательности ДНК разных организмов одного вида, например, разных людей, различаются, поэтому и организмы обладают разными свойствами — фенотипами. Есть различия в ДНК, которые не приводят к существенным отличиям и встречаются достаточно часто — это полиморфизмы. Есть мутации, которые заметно влияют на жизнедеятельность и являются достаточно редкими.
ДНК — это сложный биополимер, который состоит из нуклеотидов. Каждый нуклеотид, мономер ДНК, содержит остаток фосфорной кислоты, сахар дезоксирибозу и одно из четырех азотистых оснований: аденин (A), гуанин (G), цитозин (С) или тимин (Т). Эти мономеры соединяются ковалентно в длинные цепи, которые объединяются в двойную спираль за счет образования водородных связей между азотистыми основаниями, причем аденин может связываться только с тимином, а гуанин — с цитозином. Двойная спираль в природе чаще всего правозакрученная (B-ДНК), хотя может быть и левозакрученной (Z-ДНК), а также образовывать сложные структуры, состоящие из более чем двух одноцепочечных молекул ДНК, называемые неканоническими.
Сейчас известно, что мутации могут быть не только наследственными, но и приобретенными, а молекула ДНК не остается неизменной с начала и до конца жизни организма. При каждом делении клетки возникают новые мутации, сейчас считается, что возникает от одной до двух мутаций в каждой из дочерних клеток. Известно, что часть из этих мутаций передается по наследству.
Алексей Абызов, профессор, заведующий научной лабораторией в клинике им. Майо, поясняет: «Мутации могут возникать естественным образом (при делении клетки), а могут — при воздействии среды. Если вы выйдете на солнце, то у вас в клетках начнут появляться мутации из-за того, что ультрафиолет повреждает ДНК, и разные люди по-разному подвержены этим повреждениям. Оказывается, если взять клетки кожи из разных частей тела одного и того же человека, количество мутаций в них может отличаться в 10 раз. Для генома клеток кожи, которая защищена от постоянного воздействия солнца, например, на ноге, мутаций будет 1000–1500, а в одном фибробласте, который постоянно на свету, количество мутаций может быть в 5–10 раз больше».
РНК, как и ДНК, — это цепочка нуклеотидов, каждый из которых состоит из сахара рибозы, остатка фосфорной кислоты и азотистого основания: аденина (A), гуанина (G), урацила (U) и цитозина (C). РНК могут служить матрицами для построения белков, принимать участие в синтезе белков или выступать в роли ферментов. Существует теория, согласно которой РНК — молекула-предшественник ДНК.
Эпигенетика и неканонические структуры
По мере обнаружения новой информации о молекулярном устройстве организмов была сформулирована центральная догма молекулярной биологии, которая описывает путь реализации программы, записанной в ДНК. Считается, что информация передается по цепочке: ДНК — РНК — белок. ДНК можно представить как библиотеку «рецептов», которые по необходимости копируются, «переписываются» в РНК для «приготовления» белков.
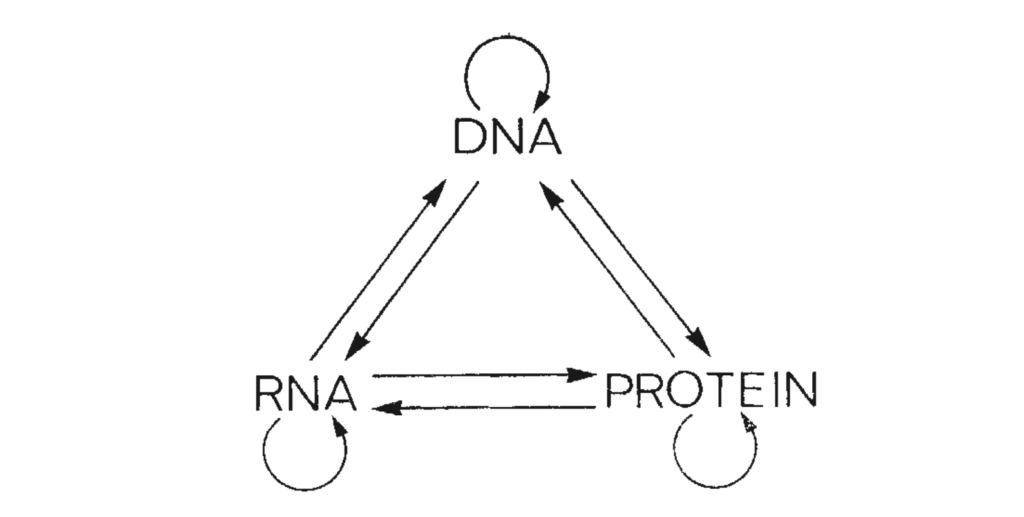
Стрелками показаны все возможные пути передачи информации между основными биополимерами: ДНК, РНК и белками
Существуют и другие операции с этими ключевыми макромолекулами: при делении клеток ДНК удваивается, а вирусы, например, могут производить операцию превращения РНК в РНК или РНК в ДНК. Также существуют различные модификации этих молекул, которые влияют на их функции и, соответственно, на организм в целом.
Всеволод Макеев добавляет: «Эпигенетика — это еще более сложное понятие, потому что она изучает “модификации”. Есть наследственность, но в результате влияния внешней среды функции или в некоторых случаях даже формы организма могут очень сильно меняться при одном и том же наследственном материале. Можно сказать, что эпигенетика изучает такие влияния среды, которые передаются в следующем поколении или, может быть, через одно: есть механизмы, которые позволяют последствия некоторых влияний среды на несколько поколений как бы затянуть».
Кроме того, существуют так называемые неканонические структуры ДНК — это отклонения формы от классической двойной спирали. В геноме существуют определенные нуклеотидные последовательности, для которых нахождение в двойной спирали при определенных условиях менее выгодно. С точки зрения физики, любое изменение конформации ДНК объясняется, главным образом, энергетической выгодностью альтернативных структур.
Дмитрий Калюжный, заведующий лабораторией ДНК-белковых взаимодействий Института молекулярной биологии имени В. А. Энгельгардта РАН, говорит: «Кроме классической B-формы, ДНК способна образовывать двойные спирали с параллельной укладкой нитей, шпилечные структуры, различные тройные спирали, в том числе гибриды с РНК, а также четверные спирали. Среди спектра неканонических структур — G-квадруплексные структуры, которые стабилизируются необычным взаимодействием гуанинов в нити ДНК, являются в настоящее время основной областью наших исследований. Сейчас стоит очень большая проблема — как можно показать существование этих структур внутри клетки».
Известно, что некоторые неканонические структуры размещаются в критически важных для функционирования клетки участках. Например, G-квадруплексы часто располагаются на теломерных участках хромосом. При удвоении ДНК, репликации, не всю молекулу удается скопировать, и эта проблема решается достраиванием дополнительного фрагмента на концах хромосом — теломеры. Обычно при каждом делении этот теломерный участок укорачивается. Известен так называемый предел Хейфлика, согласно которому клетка способна на определенное количество делений, порядка 50.
В клетке есть фермент — теломераза, который поддерживает длину хромосом, наращивая конец теломер. Данный фермент необходим для клеток, которые не должны «стареть» при делении, например в стволовых клетках. Кроме этого, в большинстве опухолевых клеток теломераза тоже активна, поэтому они могут делиться бесконечно и становятся «бессмертными». Активация и подавление теломеразы позволяют манипулировать продолжительностью жизни клетки.
Дмитрий Калюжный отмечает: «Теломерная последовательность представляет собой простые повторы, у человека и других млекопитающих это TTAGGG. Если последовательность на конце теломеры завернется в “узелок”, который уже не будет однонитевым, а будет образовывать структуру, например G-квадруплекс, то, с точки зрения фермента, это будет другая молекула. Существует область разработки малых молекул, которые могут связываться с теломерными последовательностями и изменять их структуру, тем самым предотвращая работу фермента. Есть работы, которые показывают, что их добавление к опухолевым клеткам либо сохраняет, либо уменьшает длину теломерных участков, тем останавливая бесконечное деление».
Расшифровка генома: задачи и проблемы

Фредерик Сэнгер с радиограммой последовательности ДНК. ©MRC Laboratory of Molecular Biology
ДНК, РНК, белки — важные биополимеры, и проблема получения информации об их линейном устройстве, то есть запись того, какая последовательность мономеров составляет интересующую молекулу, была впервые решена Фредериком Сэнгером в 1977 году. Так называемый метод Сэнгера позволяет читать — секвенировать — нуклеотидную последовательность ДНК.
В 2003 году был завершен проект «Геном человека» по расшифровке последовательности ДНК Homo sapiens. Но расшифровка генетического кода позволяет, по сути, лишь получить информацию о последовательности нуклеиновых кислот — текстовый файл на языке из четырех букв. И основная задача состоит в том, чтобы научиться понимать этот язык. Сейчас существует большое количество данных о последовательностях, Big Data в биологии, так что научиться на их основе получать информацию об устройстве организма и предсказывать его развитие — одна из центральных задач, и ее, в числе других наук, решает биоинформатика.
Иван Торшин рассуждает: «О чем мы говорим, когда упоминаем термин “биоинформатика”? Определений очень много, но бесспорным ядром биоинформатики является комплекс задач, лежащих в поле “центральной догмы” молекулярной биологии. Задачи биоинформатики как раз и состоят в нахождении наиболее эффективных способов перекодировки этих представлений».
Решение, предложенное Сэнгером, было оригинальным и лаконичным, а позднее оно получило развитие: сейчас существует много разных технологий секвенирования, которые применяются для решения разных задач, не только для фундаментальных исследований, но и в медицине. Для этого собирают обширную информацию о заболеваниях и связанных с ними генотипах и на ее основе изучают генетические ассоциации: прослеживают, какие изменения ДНК порождают соответствующие признаки. Однако зачастую сложно с высокой точностью определить, что конкретное место на хромосоме отвечает за конкретный признак.
Всеволод Макеев говорит: «Когда стали смотреть ассоциации для распространенных хронических болезней, например, для аутоиммунных заболеваний, психических заболеваний, выяснилось, что очень часто эти ассоциации вообще никак не связаны с участками, которые кодируют белки. Если ломаются белки, то появляется масса тяжелых наследственных нарушений, на которые сложно повлиять. Регуляторные поломки возможно компенсировать, и для этого есть много способов. Сейчас появились больше проекты по секвенированию полных геномов, и уже существует генетическое тестирование по белкам, но я думаю, что будет все больше тестов, в которые будут включать и регуляторные области. Такое секвенирование сейчас уже достаточно рутинно делают в Америке: смотрят у людей, являются ли они носителями определенных мутаций, и если да, то им разные канцерогенные воздействия существенно более вредны. Конечно, предрасположенности могут реализоваться, а могут не реализоваться. У меня ощущение, что развитие в медицине будет в направлении формулировки рекомендаций людям на основании такого генотипирования».
Мутагенез и рак
Как уже было сказано, многие мутации являются приобретенными, и это не проходит для организма бесследно. Переход нормальной ткани в опухолевую, как считается, может быть вызван мутациями, и изучение механизма возникновения изменений нуклеотидной последовательности в геноме и сопряженных с ним явлений может помочь решить медицинскую проблему.
Алексей Абызов рассказывает: «У нас есть разные уровни защиты от возникновения рака. Например, апоптоз — это запрограммированная смерть клетки, когда клетка сама “осознает”, что она не совсем правильная, и совершает “самоубийство”. Существуют и другие способы: есть такая теория, что, возможно, клетки в ткани каким-то образом между собой общаются. Они, в принципе, могут распознать неправильные клетки и некоторым образом замедлить их рост. Установлено, что каким-то образом иммунная система может отслеживать неправильные клетки и убивать их. Возможно, это связано с тем, что мутирующие клетки не распознаются как свои. Также есть механизм, который обусловлен действием внеклеточного матрикса. Побороть его и начать очень активный рост для клетки, в общем-то, сложно. Таким образом, у нас есть многоуровневая защита от рака, поэтому не очень понятно, какие условия нужны для его возникновения. Вначале думали, что это одна мутация. Сейчас разговор идет о нескольких. Вопрос в том, что нужно, наверное, что-то еще, не только мутации».
Технология редактирования генома CRISPR/Cas9, появление которой обязано длительному изучению иммунной системы бактерий, позволяет изменять генетический код, влияя на свойства организмов. Этот метод может помогать в исследованиях свойств генов и терапии наследственных заболеваний, а также применяться в сфере биотехнологий. В частности, сферой приложения CRISPR/Cas9 стало сельское хозяйство: для улучшения свойств животных и растений и предотвращения их заболеваний.

Мендель (поп арт) ©Douglas Allchin University of Minnesota
Генетика и селекция
Основными прикладными задачами, связанными с изучением генома, являются те, решение которых способно повысить уровень жизни. Селекция, защита культурных растений от патогенов и других неблагоприятных влияний окружающей среды, разумеется, входит в их число.
Важной проблемой в современной генетике растений является выявление генов, которые отвечают за признаки, важные с точки зрения сельского хозяйства: структуру урожая, его объем, устойчивость к патогенам, вегетационный период. Сложность в том, что, например, для Новосибирской области это одни параметры, а для юга России — другие, поскольку в разных регионах разная продолжительность дня и разная почва.
Антонина Киселёва, научный сотрудник лаборатории молекулярной генетики и цитогенетики растений Института цитологии и генетики СО РАН, говорит: «Мы занимаемся мягкой пшеницей, она же хлебная. У нее очень сложный геном: по сути, три немного отличающихся генома, которые слились вместе. Наша глобальная задача — выявить гены, которые регулируют признаки, влияющие на хорошую приспособленность растения к региону возделывания, чтобы в дальнейшем мы могли, как конструктор, собирать нужные параметры воедино. Конечно, это не так просто, как звучит, но в первом приближении можно сказать и так. Сейчас мы как раз пытаемся ввести технологию CRISPR-Cas9 на пшенице — ускорить время колошения пшеницы, внеся мутацию в промотор гена, который отвечает за чувствительность к фотопериоду, то есть то, как растение воспринимает длину дня».
Настоящее и будущее
В 2000-е годы генетика стала стремительно развиваться с точки зрения технического оснащения: совершенствуются технологии секвенирования, генерируются разнообразные базы данных генетической информации о самых разных организмах, группы ученых по всему миру работают над «переводом» ДНК на человеческий язык и далее — в методы.
Также с развитием технологий геномного редактирования эксперименты в области генетики вызывают все больше обсуждений с точки зрения этики. Требуется обстоятельный и постоянный диалог, чтобы мы могли соизмерять возможности технологии и способность контролировать последствия ее применения.
1

