Две группы ученых из США, Японии и Австралии независимо друг от друга описали (1, 2) новый инструмент редактирования генома прокариот, который использует «РНК-мосты» (bridge RNA) мобильных генетических элементов из семейств IS110 и IS1111. Систем, способных вносить правки в геном живых организмов, нам известно уже не одна и не две, некоторые из них даже добрались до клинической практики. Давайте разберемся, в чем, собственно, прелесть только что изобретенных инструментов и претендуют ли они вообще на то, чтобы заменить систему CRISPR/Cas в лаборатории.
.
Молекулярная копипаста
Слова «редактирование генома» могут обозначать несколько операций:
- удаление или банальную поломку той или иной последовательности нуклеотидов;
- замену одной последовательности на другую;
- добавление в геном новых последовательностей.
Тут хорошо работает параллель с текстовыми редакторами. До появления цифровых программ для того, чтобы исправить текст в книге и вам нужно было физически, при помощи ручки, разметить рукопись, по этой разметке сделать новую копию, а затем отправить ее в типографию, чтобы наборщики, смотря в нее, собрали из литер на верстатке строки и уложили их под пресс. Это выглядит очень долгим и утомительным делом, особенно сегодня, когда зачастую дело даже до типографии не доходит — открыл документ, что-то вырезал, где-то вставил, сохранил, опубликовал.
Те же манипуляции мы, в целом, умеем теперь проводить и с геномом — благо он в нашем нынешнем представлении представляет собой текст, написанный на языке из четырех букв. Мы умеем удалять из него буквы нуклеотидов, мы умеем их добавлять. Для этого у нас есть разнообразные молекулярные инструменты.
Самые винтажные из них известны уже больше полувека: в 1972 году Пол Берг получил первую в истории химерную ДНК, вставив в геном одного вируса другой (плюс оперон кишечной палочки). Через год биологи продемонстрировали, что если ввести в клетку кишечной палочки плазмиды с химерными генами резистентности, бактерии начинают ими пользоваться; в 1974-м дело дошло уже и до мышей.
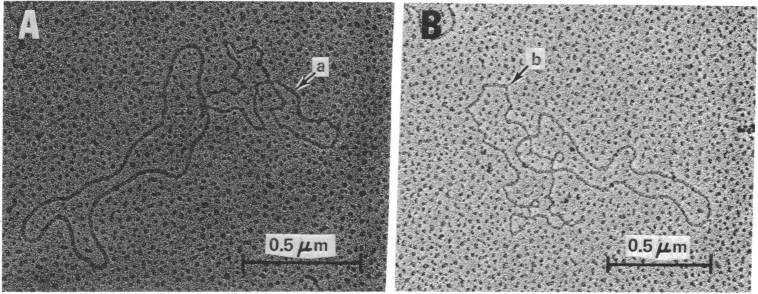
(А) и (B): Химерные плазмиды, кодирующие резистентность к тетрациклину и стрептомицину. Литерой (а) обозначен фрагмент, отвечающий за резистентность к стрептомицину у бактерий-возбудителей брюшного тифа. Литерой (b) обозначен фрагмент, кодирующий резистентность к тетрациклину у кишечной палочки. Источник: Stanley N. Cohen et al. / Proceedings of the National Academy of Sciences, 1973
Берг резал рестриктазами, а склеивал лигазами. Сегодня с бактериями нередко работают тем же самым. А когда речь заходит о медицине (и, соответственно, редактуре генома человека), то говорят, как правило о «большой тройке»: РНК-интерференции, системе CRISPR/Cas и цинковых пальцах (ZFN) с TALEN.
Однако эндонуклеазы рестрикции и CRISPR/Cas в одиночестве способны только распознать цель и расщепить в относительной близости от нее двойную цепь ДНК, а системы на базе РНК-интерференции — лишь заглушить активность целевого гена, вмешавшись в процесс трансляции его матричной РНК. То есть, например, если вы пользуетесь РНК-интерференцией, то ничего сверх выключения какого-то гена вы сделать не можете. Возвращаясь к метафоре с текстом — буквы все еще можно только зачеркнуть или вырезать.
Молекулярных инструментов, которые сами по себе бы могли сделать что-то больше, чем просто дырку или заглушку в геноме, у нас нет. Новые нуклеотиды добавляются, по большому счету, обманом: вместе с молекулярными ножницами вы вводите в клетку как можно больше копий синтезированных вами последовательностей, в надежде что клеточные системы репарации ДНК, среагировав на нарушение целостности цепи ДНК, воспользуются при починке введенным вами образцом. То есть как минимум половина дела полностью на аутсорсе.
С таким сценарием, естественно, есть типичные для аутсорса проблемы — когда работу делает кто-то другой, то повлиять на качество его труда ты можешь в ограниченной степени. Поэтому главная проблема молекулярных биологов, развивающих платформу CRISPR/Cas сегодня это офф-таргеты, появление правок там, где их быть не должно. Например, недавно группа ученых под руководством нобелевского лауреата Сванте Паабо предположила, что значительная часть этих проблем связана с конкуренцией разных механизмов клеточной репарации после «укуса» Cas-белка:
- первый, негомологичное соединение концов, идет сшивать возникшую рану,
- другой, гомологичная рекомбинация, в это же время пытается вставить туда последовательность, которую берет с парной хромосомы.
Эксперименты показали, что сломав в клетке ген, связанный с работой негомологичного соединения концов, число нецелевых мутаций в результате работы CRISPR/Cas сокращается. Возможно, это решение. Хотя все еще не универсальный редактор.
Мы хотим большего
Еще до появления первых геномных редакторов мы открыли немало мобильных генетических элементов (МГЭ) — нуклеотидных последовательностей, которые сами по себе свободно мигрируют по геномам живых организмов. Какие-то МГЭ производят свои копии и отправляют их дальше по цепочке, другие буквально вырезают себя из одного места и вставляют в другое. Из этих геномных паразитов состоит большая часть геномов организмов. Например, в геноме людей на их долю приходится почти 80 процентов, а миграция прыгающих генов влияет на изменчивость видов — переезжая с место на место или добавляя в последовательность все больше своих копий, МГЭ иногда забираются в гены, отвечающие за производство тех или иных белков, и тем самым влияют на их экспрессию.
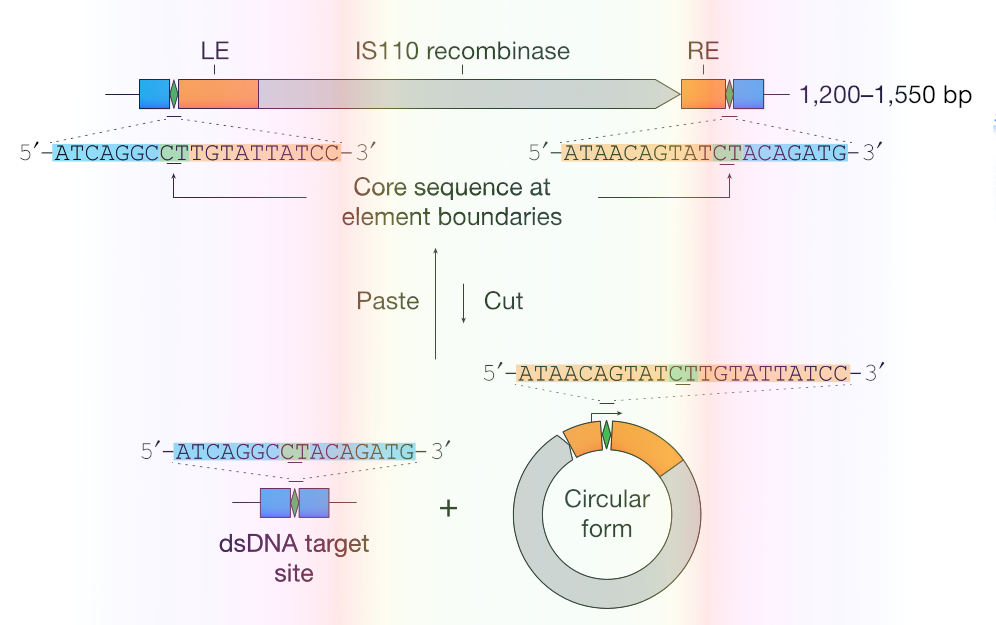
Собственно, кандидат в геноредакторы нового поколения заимствует свое устройство как раз у таких мобильных генетических элементов из семейства инсерционных последовательностей (IS-элементов) бактерий. Это одни из самых простых МГЭ: весь их «код» только и позволяет им, что выскочить из генома и встроиться обратно. Некоторые из них даже входят в состав более крупных геномных паразитов, транспозонов — с оглядкой на это некоторые исследователи допускают, что IS-элементы можно рассматривать в качестве эдаких базовых компонентов, из которых в действительности составляются все мобильные генетические элементы вообще. В начале 2000-х годов ученые заметили, что некоторые виды IS-элементов с подозрительной частотой встраиваются в одни и те же участки генома бактерий Coxiella burnetii, возбудителей Ку-лихорадки. А другие ученые двадцать лет спустя, наконец, нашли время взглянуть повнимательнее как на сами последовательности, так и на то, как те мигрируют.
Так они выяснили, что когда МГЭ из семейства IS110 выбирается из генома, он принимает форму кольца и экспрессирует некодирующую РНК, на которой формируются две петли, одна из которых комплементарна, собственно, IS110, а другая — фрагменту ДНК последовательности, в которую тот имеет обыкновение встраиваться. Причем эти распознающие последовательности уникальны для обеих нитей как своего пассажира, так и своей цели, а значит эта РНК помимо того, что с одинаковой строгостью опознает обоих, но и связывается с ними в одной и той же позиции. Группа Патрика Сюя дала ей имя «РНК-моста», их коллеги из Сиднея назвали ее же «РНК-искателем» (seeker RNA).
Филогенетическое древо для 274 известных ферментов рекомбинации в семействе IS110. Источник: Matthew G. Durrant et al. / Nature, 2024
Все, что после этого оставалось сделать ученым — это продемонстрировать, что они могут позаимствовать у IS110 этот механизм. Что они и сделали, синтезировав свой аналог одного из представителей семейства, IS621, и отправили всю эту конструкцию добавлять в геном кишечной палочки белок зеленого флуоресцентного белка (GFP).
После этого ученые перекодировали систему так, чтобы она наводилась строго на один и тот же участок генома кишечной палочки. Та в среднем попала в цель с 69-процентной точностью. А когда размер одной из наводящих последовательностей увеличили с четырех тысяч пар оснований до семи тысяч — на эту идею ученых натолкнул тот факт, что у некоторых других МГЭ из того же семейства этот участок бывает длиннее, — точность редактирования увеличилась до 84 процентов.
Ура?
Это не для людей
«Первое, что бросается в глаза — количество специфических контактов маловато для эффективного применения в больших геномах вроде нашего, — говорит Дмитрий Купраш, профессор кафедры молекулярной и клеточной биологии Физтех-школы биологической и медицинской физики (ФМБФ МФТИ). — Крутой новый механизм, потенциальный инструмент для геномной инженерии бактерий и возможно дрожжей, но похоже пока не млекопитающих. Был бы пригоден для нас, авторы написали бы об этом в дискуссии, а они этого не делают. Указано на эволюционное разнообразие этого семейства, с намеком на возможность найти что-то получше. Однако это, во-первых, дело будущего, а во-вторых — сколько “крисперов” уже наоткрывали, а используют все Cas9. Так что это несомненно важное открытие, третья глава в бурной истории РНК-зависимых нуклеаз и, вероятно, крутой инструмент для биотехнологии. Но если хотите назвать его «геномным редактором», имея в виду редактирование клеток человека — нет».
«Мне кажется, что авторы немного лукавят, говоря о том, что они придумали принципиально новый метод, — добавляет к этому Дмитрий Карпов, доцент кафедры молекулярной и клеточной биологии ФБМФ МФТИ. — Подобный метод уже известен, называется “Таргетрон”».
Таргетрон использует механику наводки и встраивания, который ученые подсмотрели у других мобильных генетических элементов прокариот, интронов. То преимущество, которое у них есть по сравнению с популярными ныне CRISPR/Cas системами, заключается в том, что они позволяют встраивать в геном цели фрагменты ДНК, не привлекая для этого внутриклеточные механизмы репарации ДНК.
Интроны имеют намного более серьезную структуру, продолжает Карпов. «Он кодирует фермент, который как раз выполняет все это множество функций с распознаванием РНК, синтезом копий кодирующей ДНК. Видимо, также он способен вносить разрез в ДНК и потом, достраивать эту копию кодирующей ДНК до двухцепочечного состояния. То есть бактериальные интроны это такие абсолютно самодостаточные элементы, которые могут скакать, перемещаться между участками генома в бактериях. Это, грубо говоря, такие эгоистичные гены, у них всё с собой, они всё сами кодируют, и некоторые имеют даже специфичность — те, которые как раз используются в технологии редактирования “Таргетрона”. У них есть несколько участков в их большой разлапистой структуре, которые отвечают за то, куда именно будет встроено тело этого интрона».
Ключевым отличием РНК-мостов от таргетронов собеседник «ЗН» называет их «двурукость» — способность наводиться сразу по двум нитям ДНК. «То есть, видимо, специфичность тут уже повыше, поскольку у таргетронов специфичность на очень коротких участках, пять-семь нуклеотидов». Специфичность РНК-мостов чисто количественно такая же, но двойная: нижнюю цепь они распознают последовательностью длиной в восемь-девять нуклеотидов, а верхнюю — от четырех до семи.
Самое главное в том, что в масштабах генома человека на данный момент ни та, ни другая технологии не имеют достаточной точности. «Это в рамках генома бактерии все очень просто, поскольку там 4 миллиона пар оснований, и все, — объясняет Дмитрий Карпов. — А у человека 3 миллиарда пар оснований и соотношение, то есть риски того, чтобы найти какие то нецелевые участки, гораздо выше. То есть первая проблема на пути становления технологии — это побороть специфичность».
Разница в масштабе материала, который нужно перебрать редактору в поисках своей цели, важна еще потому, что в клетках шныряют рибонуклеазы, ферменты, которые расщепляют незащищенные одноцепочечные РНК. К числу их жертв относятся и комплексы с РНК-мостами — и чем дольше они ищут свою цель, тем меньше у них шансов выжить.
Помимо этого, продолжает ученый, подобным РНК нужно принимать определенную трехмерную структуру, чтобы работать как надо. А для этого необходимо нейтрализовать заряд фосфатных групп у РНК — и самым важным металлом, нейтрализующим заряд в клетке, является магний. И если его не хватает, то тогда РНК не сможет принять компактную структуру — оттого у подобных систем и снижается эффективность встройки в геном эукариот, потому что в их клетках нет такой концентрации магния, как у бактерий.
Это, кстати, тоже делает их более уязвимыми перед рибонуклеазами — более рыхлая структура, естественно, быстрее разлагается. «Поэтому следующая проблема для того, чтобы стать технологией, применимой к эукариотам эффективно — это как раз стабильность этих РНК, их надо как-то защитить от рибонуклеаз, — продолжает Карпов. — Насколько я знаю, даже у CRISPR/Cas систем тоже есть эта проблема. Пока гидовая РНК не образовала комплекс с белком Cas, она беззащитна против рибонуклеаз и быстро ими уничтожается. И поэтому один из способов оптимизации активности криспр-кас систем — это повышение экспрессии направляющей РНК. Вот чем больше ее, тем выше шансы выжить и дожить до встречи с Cas-белком, который их защитит».
Но самое главное, говорит собеседник «ЗН», в хроматине. Геном бактерий практически никак не упакован, в то время как ДНК эукариотов наматывается на белки-гистоны, и если цель редактора находится где-то в глубине такой катушки, до нее физически сложно дотянуться.
«Возможно, с этого надо было начать? — смеется Карпов, — Самая большая проблема для всех таких систем, они очень чувствительны к структуре хроматина. И, как правило, эффективно редактируются те участки, что слабо связаны с нуклеосомами (так называются, собственно, структурные единицы из ДНК, намотанных на гистоны). А это какие участки? Это те участки, которые активно транскрибируются, например. Поэтому легко редактировать высоко экспрессирующиеся гены. И когда появляются какие-то новые технологии, люди стараются редактировать рибосомные гены[, чтобы показать их эффективность]. А рибосомные гены фактически лишены хроматина, это почти голая ДНК, туда можно очень много чего встроить, потому что там постоянно идет процесс транскрипции. Но как только мы перейдём к другим генам, которые не так интенсивно транскрибируются… Почему в CRISPR/Cas до сих пор чаще всего используется белок Cas9, [который мы нашли в] Streptococcus pyogenes? Потому что у Cas9 что-то такое есть в структуре белка, что позволяет ему выдерживать конкуренцию с гистонами, их эффективно как-то убирать. Есть даже технология, когда используют просто “беззубый”, лишенный нуклеазной активности Cas9, он просто связывается с участками целевого локуса, и потом туда направляется, допустим, другая нуклеаза, например Cas12, которая гораздо чувствительнее структуре хроматина, и вот тогда она эффективно режет мишень».
Утешительное заключение
CRISPR/Cas произвел революцию в биотехнологиях в первую очередь своей простотой. С ее появлением стало возможно вносить правки в геном любых клеток, будь то бактерии или люди, с легкостью, которой не предоставляют никакие другие инструменты: вам больше не нужно собирать сложный корабль, на котором стоит система навигации, инструмент для разрезания цепи ДНК и нужная вам вставка. Вы просто синтезируете короткие РНК-гиды, комплементарные вашей цели и потом одной рукой закидываете в клетку их, другой рукой сыпете сверху Cas-белки, дальше они уже сами. Гиды найдут свои цели, Cas-белки найдут гиды и расщепят в этом месте цепь ДНК, а внутриклеточная система репарации сошьет ее обратно.
Необходимости в универсальном редакторе, как таковом, нет. Прикладная ценность геноредакторов никак не страдает и не увеличивается в зависимости от их архитектурной элегантности. Эта ценность зависит от другой метрики — эффективности работы. Область применения РНК-мостов пока что ограничена работой в бактериях. Возможно, этим она и ограничится.
Но даже так их пользователям будет намного удобнее: ведь когда ты можешь внести в правки текст, не переключаясь между несколькими редакторами, процесс письма и публикации намного ускоряется.

