Прежде чем стать лекарством, каждый новый препарат должен пройти тернистый путь. К счастью, сейчас фармакологические разработки все меньше полагаются на случайные находки и изнурительный перебор взаимодействий веществ в эксперименте. Ученые МФТИ подробно описали состояние этой проблематики в двух связанных обзорах для журнала «Биохимия» (1 и 2). В центре внимания — создание действующих на сопряженные с G-белками рецепторы (GPCR) препаратов с помощью методов структурной биологии и виртуального поиска лигандов на основе структуры мишени.
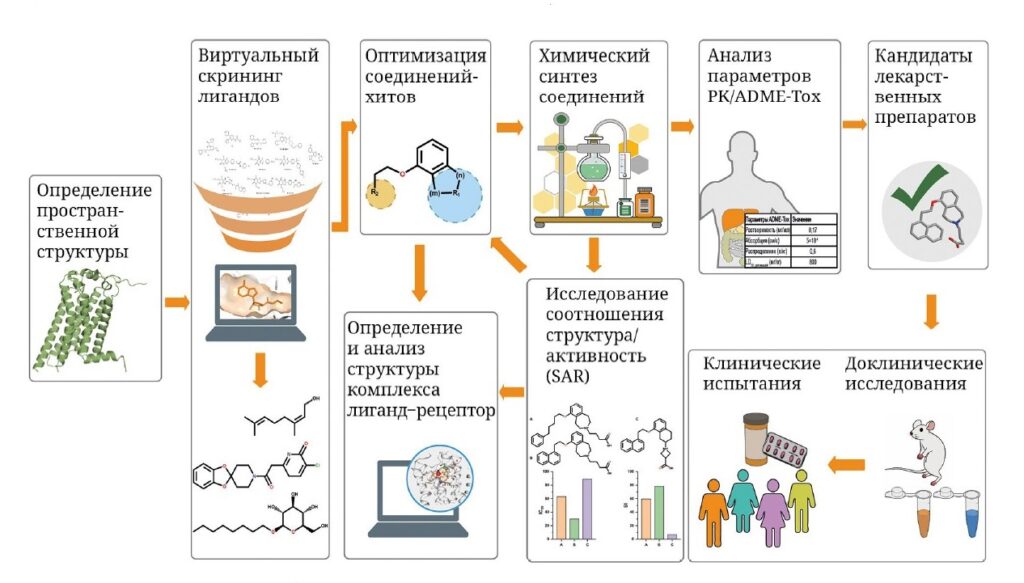
Основные стадии разработки лекарств на основе структуры (SBDD). Источник: журнал «Биохимия»
Медики используют в качестве лекарств сотни различных соединений, и их список постоянно растет. Дело в том, что некоторые болезни продолжают с врачами «гонку вооружений»: например, бактерии и раковые опухоли теряют чувствительность к современным препаратам. Другие, скажем, болезнь Альцгеймера и другие нейродегенерации до сих пор не научились эффективно лечить.
Поэтому необходимы постоянный поиск и введение в практику все новых лекарств. Полный цикл их создания — это очень дорогое и трудоемкое дело, включающее в себя ряд этапов. Сперва исследователи ищут наиболее перспективные соединения-кандидаты, из которых выбирают самые многообещающие (соединения-лидеры). Далее их структуру могут оптимизировать для придания нужных свойств и проверяют в доклинических испытаниях на клетках и животных. Лишь затем приступают к оценке безопасности и эффективности с участием людей.
Разумеется, ученые стремятся упростить и ускорить все возможные этапы создания лекарств, используя при этом рациональный дизайн и другие подходы. Важным подспорьем в этом стали методы биоинформатики и молекулярного моделирования, включая ИИ, которые сейчас бурно развиваются. Яркий пример — программа AlphaFold3, которая достаточно точно предсказывает структуру белка по его аминокислотной последовательности. В этом году ее создателей удостоили Нобелевской премии по химии.
Огромные успехи делает и структурная биология в целом — описание из эксперимента трехмерной формы биомолекул, которая всегда тесно связана с их функциями. Прогресс возможен благодаря новым экспериментальным методикам, с помощью которых достоверно описали множество структур самых разных белков.
Этой динамичной и очень важной области исследований посвящены две статьи журнала «Биохимия». Ее авторы — команда ученых из МФТИ — сосредоточились на соединениях, которые действуют на GPCR (G-protein coupled receptors). Это обширная группа рецепторов, которые запускают различные клеточные процессы и связаны с возникновением и развитием болезней. Они находятся в мембране и состоят из семи погруженных в нее альфа-спиральных участков. При активации под действием света или при связывании специфичной молекулы (лиганда) GPCR меняет свою трехмерную форму (конформацию) и запускает различные реакции внутри клетки. В том числе с помощью G-белка, с которым работает в связке.
G-белок представляет собой фермент — ГТФазу, которая при активации превращает молекулу ГДФ в ГТФ, добавляя к ней остаток фосфорной кислоты. Это запускает целый каскад сложных взаимодействий молекул, которые помогают клетке регулировать свое состояние и могут нарушаться при болезни. Поэтому неудивительно, что более трети всех уже одобренных к использованию лекарств действуют именно на GPCR. Множество таких препаратов находятся на разных фазах испытаний и вскоре могут поступить на вооружение врачей.
Ученые описали структурно-биологические аспекты создания лекарств. Здесь особенно велика роль «сухой биологии», а именно виртуального скрининга (поиска нужного лиганда на основе компьютерного анализа и моделирования). Процесс напоминает подбор к замку ключа, который должен оказать очень избирательный эффект. Благодаря ему дорогой и малоэффективный химический скрининг — перебор взаимодействий лиганда с рецепторов в лаборатории (то есть «мокром» эксперименте) — требуется все реже.
Авторы также описали современные методы кристаллизации GPCR, учитывающие сложности работы с этими мембранными белками, которые имеют подвижную конформацию. Затем рассмотрели анализ их структуры, использующий рассеяние рентгеновских лучей на белковых кристаллах. А также криоэлектронную микроскопию, основанную на пропускании пучка электронов через тонкий слой замороженного вещества.
Исследователи остановились и на другой стороне вопроса — лигандах, которые связывают GPCR. Рассмотрены новые методы виртуального скрининга, в том числе молекулярный докинг, который предсказывает положение лиганда в структуре рецептора. Также описано экспериментальное изучение взаимодействия лигандов с рецепторами и функционального ответа на него у культуры клеток.
«Тринадцать лет и около двух миллиардов долларов — столько в среднем требуется фармацевтическим компаниям, чтобы обеспечить нуждающихся новым лекарством. Не удивительно, что есть стремление оптимизировать этот процесс. Методы структурной биологии вместе с виртуальным поиском активных молекул и клеточными тестами помогают сделать разработку терапевтических препаратов более точной и эффективной. В обзорных статьях мы с коллегами постарались осветить особенности такого подхода с точки зрения методологии и считаем, что их прочтение будет крайне полезным. Как специалистам, так и тем, кто просто интересуется данным направлением практической науки», — рассказала Полина Хорн, старший научный сотрудник Центра исследований молекулярных механизмов старения и возрастных заболеваний МФТИ.

