Коллектив российских ученых исследовал секрет ядовитых желез томизуса наполненного, принадлежащего к семейству пауков-бокоходов. В яде обнаружен пептид — пуротоксин-6, который может стать основой для разработки анальгетиков нового поколения. Применение пуротоксина-6 не влияет на вкусовые ощущения, что выгодно отличает его от других препаратов со сходным механизмом действия. Результаты работы опубликованы в журнале Molecular Therapy.
Боль — это защитная реакция на внешний раздражитель, например, на острый предмет, который ранит организм. Только зачастую причиной боли являются различные заболевания, и она уже не служит предупреждением, а вызывает страдания. Для обезболивания применяют анальгетики. Данные медикаменты, кроме терапевтического, могут оказывать и побочное действие. Возможны спазмы желудочно-кишечного тракта, падение артериального давления и головокружение. Кроме того, некоторые анальгетики вызывают привыкание, и их прием становится неэффективным. В этой связи поиск новых анальгетиков — актуальная проблема. Для ее решения необходимо учитывать механизм развития болевого синдрома на клеточном и молекулярном уровнях.
От внешней среды содержимое клетки отделяют мембраны, образованные липидами. В мембранах чувствительных нейронов расположены болевые рецепторы, в частности P2X3-рецепторы, именуемые также пуриновыми. Митохондрии — структурные элементы клеток — синтезируют молекулы аденозинтрифосфата (АТФ), которые обеспечивают организм энергией. Попадание АТФ наружу клеток активирует P2X3-рецепторы. Генерируется биоэлектрическая волна и распространяется по нервным клеткам. Спинной мозг обрабатывает эти нервные импульсы и передает их в головной мозг. В результате человек чувствует боль. Победить ее позволит блокада P2X3-рецепторов с помощью специальных веществ.
Для этого коллектив российских ученых изучает пептиды или небольшие белки — молекулы, содержащие не более 100 остатков аминокислот, связанных в цепочку. Особый интерес представляют пептиды, выделенные из природных ядов. Внимание исследователей привлек секрет ядовитых желез томизуса наполненного. Этот паук принадлежит к семейству пауков-бокоходов. Его размер составляет от 2 мм до 1 см. Он не плетет паутину, а ловит своих жертв — насекомых — передними лапами, также может питаться цветочной пыльцой. Для человека данный вид пауков не опасен.
Ученые получили секрет посредством электрической стимуляции ядовитых желез паука. Чтобы изучить состав, яд разделили на компоненты с помощью обращенно-фазовой хроматографии. Разделение происходило при высоком давлении на неполярном сорбенте, который остается неподвижным в ходе процесса.
В результате ученые выделили чистый пептид, который назвали пуротоксином-6 (PT6). Его молекулярная масса составляет 3313 г/моль. Данная величина была определена путем масс-спектрометрического анализа, когда исследуемый объект переводили в ионизированную газовую фазу, а затем регистрировали время пролета иона, разогнанного в магнитном поле, от места ионизации до детектора.
Строение пуротоксина-6 было изучено с помощью спектроскопии ядерного магнитного резонанса. Под ядерным магнитным резонансом понимают поглощение электромагнитной энергии ядром вещества во внешнем магнитном поле на определенной частоте. В пуротоксине-6 был обнаружен 31 остаток аминокислот и 3 дисульфидных связи ─S─S─. Молекула укладывается в своеобразный «узел» (Рисунок 1).
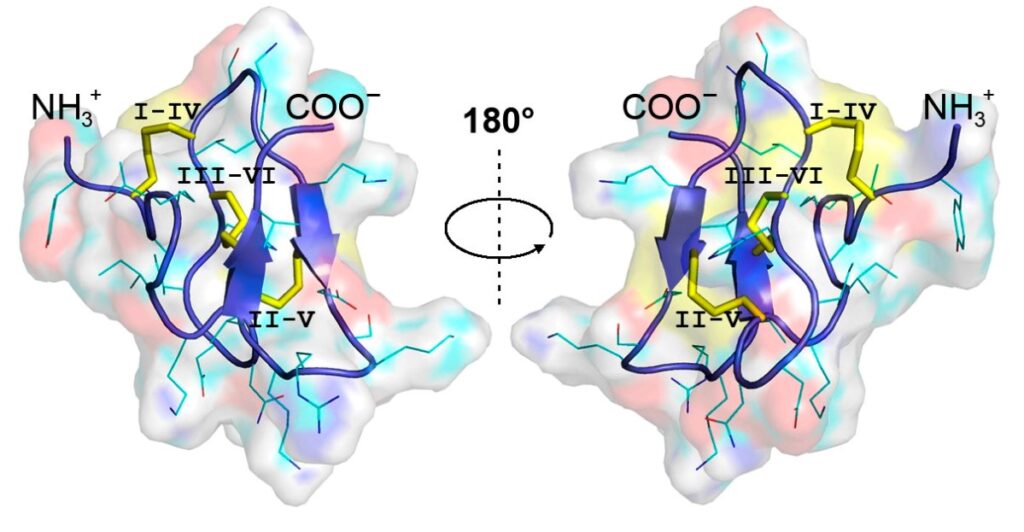
Рисунок 1. Пространственная организация молекулы пуротоксина-6. Ленточная модель третичной структуры окрашена синим цветом, дисульфидные связи — желтым. Боковые цепи изображены в виде линий, атомы водорода не обозначены. На воображаемой полупрозрачной поверхности молекулы атомы показаны цветами: углерод — голубым, водород — серым, азот — синим, кислород — красным, сера — желтым. Источник: Molecular Therapy.
«Пуротоксин-6 имеет компактную пространственную структуру,— отметил Александр Василевский, доцент кафедры физико-химической биологии и биотехнологии МФТИ. — Даже низкие дозы этого пептида, введенные мышам подкожно или внутримышечно, избирательно ингибируют P2X3-рецепторы, оказывая выраженное болеутоляющее действие».
Надо отметить, что рецепторы P2X3 отвечают не только за болевые, но и за вкусовые ощущения. Следовательно, прием веществ, блокирующих эти рецепторы, может привести к искажению или потере вкуса. Чтобы оценить указанный побочный эффект, ученые провели эксперименты на мышах. Они наблюдали за пищевым поведением грызунов после введения 4 препаратов: подкожно 0,9 % раствора хлорида натрия и 0,01–1,00 мг/кг пуротоксина-6, перорально 30 мг/кг джефапиксанта, внутрибрюшинно 20 мг/кг камлипиксанта. Раствор хлорида натрия был выбран в качестве образца сравнения. Джефапиксант и камлипиксант — ингибиторы P2X3-рецепторов, которые разрабатываются фармацевтическими компаниями. Как показали исследования, пуротоксин-6 не вызывает значимых изменений вкуса даже в высоких дозировках — до 1 мг/кг (Рисунок 2).
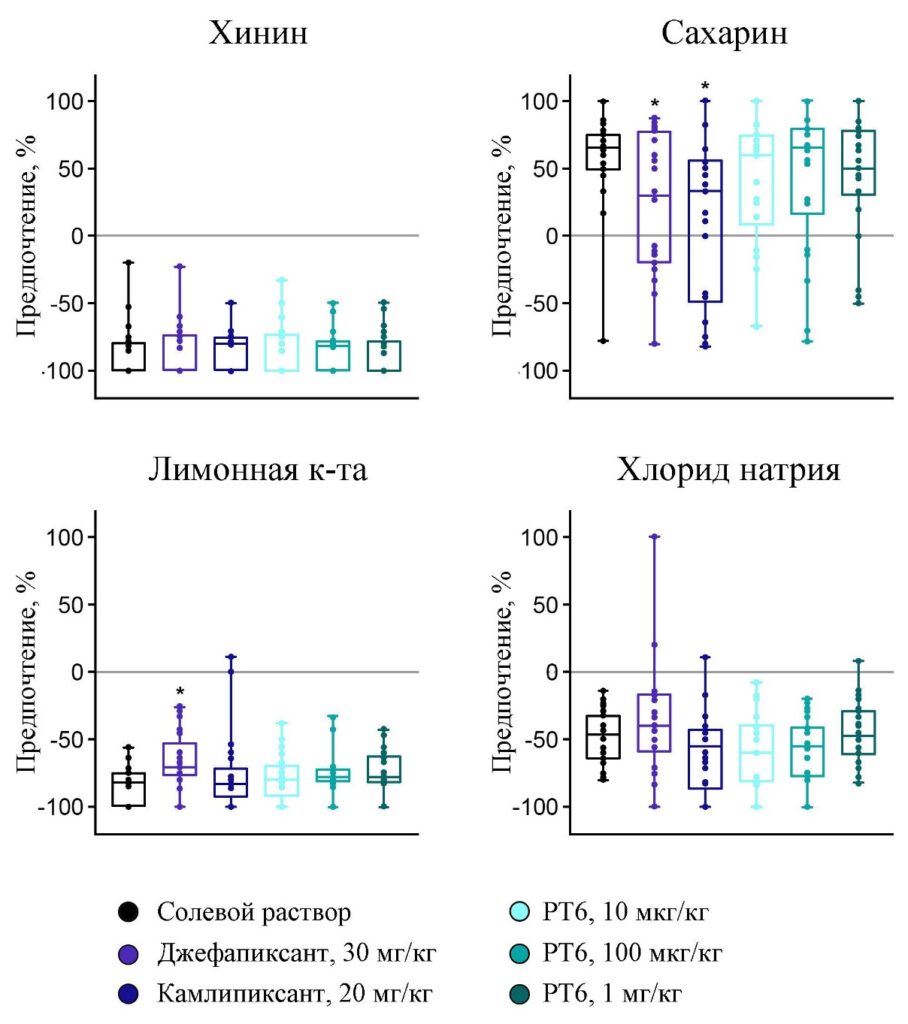
Рисунок 2. Диаграммы, показывающие вкусовые предпочтения мышей к горькому — 0,3 ммоль/л раствору хинина, сладкому — 10 ммоль/л раствору сахарина, кислому — 10 ммоль/л раствору лимонной кислоты, соленому — 300 ммоль/л раствору хлорида натрия. Перед опытами мышам вводились препараты: хлорид натрия, пуротоксин-6, джефапиксант и камлипиксант. Источник: Molecular Therapy.
Пуротоксин-6 демонстрирует высокую эффективность и отсутствие побочных эффектов по сравнению с традиционными и недавно зарегистрированными анальгетиками. Следовательно, данный пептид, выделенный из ядовитых желез паука, может стать основой для разработки лекарств, назначаемых при остеоартрите, невралгии тройничного нерва и других заболеваниях, сопровождающихся выраженным болевым синдромом.
Работа выполнена учеными из Института биоорганической химии им. академиков М. М. Шемякина и Ю. А. Овчинникова РАН, компании «Анальгетики будущего», Института биофизики клетки РАН, Института фундаментальной медицины и биологии Казанского федерального университета, Центра высокоточного редактирования и генетических технологий для биомедицины Института биологии гена РАН, кафедры физико-химической биологии и биотехнологии Физтех-школы биологической и медицинской физики МФТИ и Центра исследований молекулярных механизмов старения и возрастных заболеваний ЛФИ МФТИ, Института медико-биологических проблем РАН, НИИ фармакологии им. В. В. Закусова.

